ACS Nano | 具有非凡灵敏度的等离子体纳米传感器在纳米尺度界面的对映体识别性能
今天与大家分享一篇发表在ACS Nano上的文章,标题是“具有非凡灵敏度的等离子体纳米传感器在纳米尺度界面的对映体识别性能”。本文的通讯作者为北京理工大学物理学院的的王荣瑶教授以及中科院化学研究所的刘鸣华教授。
分子手性识别在生命系统的手性生成和转移中起着关键的作用,在手性分离及软纳米机器人等多种应用的发展方面做出了重要贡献。为了探测手性识别,迄今为止报道的大多数分子传感器的设计和制备都是基于宿主-客体与发色团或荧光团的络合。然而,它涉及繁琐的程序和复杂的化学合成,由此阻碍了其实际应用。在本文中,作者报道了一种等离子体手性光学检测器进行分子手性识别,而不需要一个发色团或荧光团单元。这种简单的方法是基于等离子体纳米转换器,它可以将发生在纳米界面的分子手性识别转化为不对称放大的等离子体圆二色性读数,实现对映特异性识别和小分子氨基酸对映体过量的定量测定。重要的是,这种基于等离子体的手性检测使得外消旋体及近外消旋体分子分析物的圆二色信号有102-103扩增,显示了对宿主-客体对映选择性相互作用的非凡敏感性。此外,这一手性光学传感设计还具有易于操控、经济有效和明确的界面分子手性的优点,在生物学、立体化学和药剂学中的对映选择性高通量筛选等方面具有可观的应用前景。
具体来说,在这一工作中作者报道了一种基于等离子体的手性光学传感器的设计,用于检测和表征溶液相中纳米级界面上的分子手性(图1)。在这里,具有明确的手性结构的自组装超分子扭曲原纤维被设计具有双重功能(左,图1a)。首先,作为手性主体与对映体(手性客体)相互作用,它们产生非对映体对的界面配合物(中,图1a)。其次,它们是一个手性模板,引导金纳米棒(GNRs)产生特定结构的手性排列。在之前的研究中,模板等离子体手性通常显示出显著的等离子体圆偏振(PCD)效应,而模板本身的ECD活性较弱。结果表明,等离子体手性模板的原纤维含有或不含有 (case II, case I, Figure 1b)非对映体复合物是不同的,其PCD读数显示出不同的振幅(红色和蓝色实线,图1b)。值得注意的是,由于非对映体配合物的存在,手性排列的GNRs的形成将涉及到分子手性信息的两个组分的共转移。一个来自手性原纤维;另一种来自非对映体对的界面配合物。由于模板效应,前者可以导致具有明确CD特征的定向PCD生成,而后者会在模板等离子体的手性上引入手性扰动。对于非对映体对施加的不对称扰动,等离子体手性的诱导修饰,如手性排列的GNRs的几何变化,可能是不同的,导致可区分的PCD读数,也由此提出了一种利用基于PCD的手性光学放大器来检测和表征弱分子手性的方法。
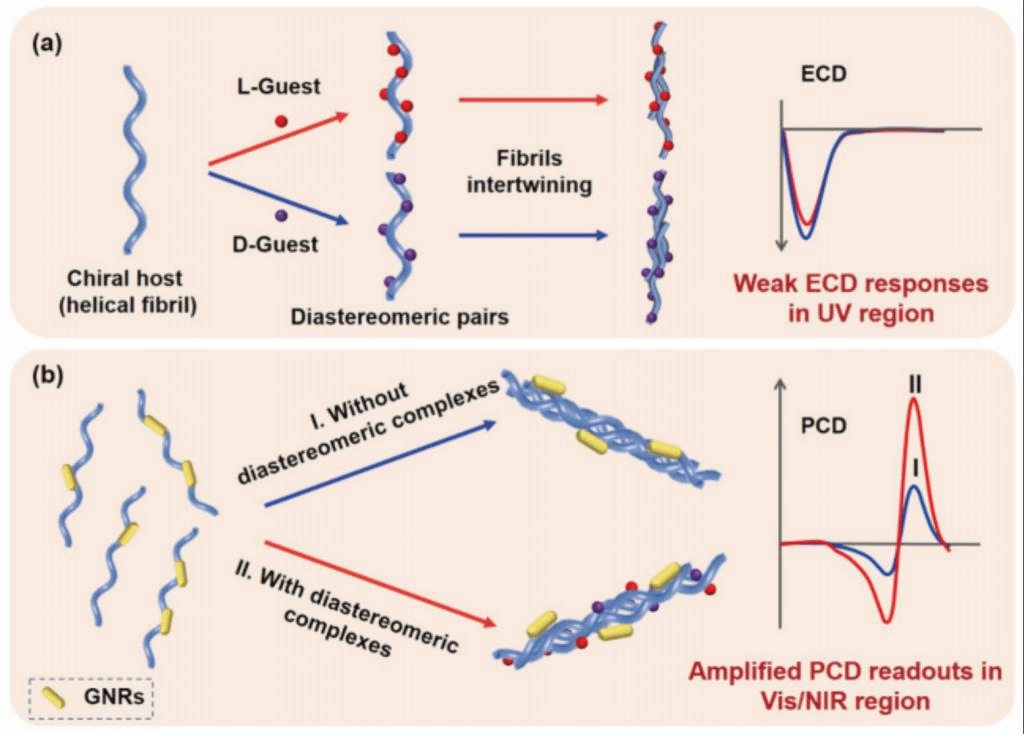
图1、基于等离子体手性光学传感器的设计示意图。(a)手性超分子原纤维(左,手性宿主)与客体分子的L-和d-对映体相互作用产生非对映体对(中间)。非对映体配合物的存在被认为会不对称地扰动相互缠绕的原纤维的手性,这里用强度略有不同的弱ECD响应(右)来表示。(b)在两种不同的情况下,手性信息从预制原纤维(作为手性模板)转移到gnr的空间排列: (I)在没有非对映体复合物的情况下,由缠绕原纤维模板化的gnr的手性排列将产生具有明确特征的PCD信号(蓝色实线)。(II)在原纤维界面上的非对映体配合物,引入原纤维上的手性扰动会对模板手性排列的gnr发生几何修饰,从而使PCD响应(红色实线)比前一种情况更强(假定)。
凝胶因子及N-月桂酰谷氨酸二正丁酰胺(GP-1)被用于制造超分子原纤维。具有左或右螺旋结构的原纤维(LH/RH)的手性来源于L-/D-GP1分子,在由丙二醇(PG)和水组成的共溶剂中获得(体积比3:110)。经过统计,LH原纤维(图2a)的宽度在20-80nm范围内(>90%),半螺距在400-700nm之间(>80%),RH原纤维也得到了类似的统计结果。这些预先形成的LH/RH原纤维在紫外区域(215-300nm)显示出了镜像对称的ECD光谱(图2b),然后作为模板诱导GNRs实现手性排列。在这里,驱动纳米棒在原纤维上吸附的相互作用主要是由静电力实现的,这也由ζ电势测量所证明,CTAB包覆的GNRs的ζ电位值为正,而LH/RH原纤维则为负值。从图2c中的扫描电子显微镜(SEM)图像中可以看出缠绕的LH/RH原纤维上观察到在侧面手性排列的GNRs粒子间距在60-140nm范围内并且在LH和RH纤维模板上的手性排列的GNRs显示了镜像的PCD响应信号(图2d)。值得注意的是,与单个GNRs的尺寸(65 nm×22 nm)相比,手性排列中的平均粒子间距(D)要大得多,结果显示在LH模板的平均值为144nm,RH模板的平均值为143nm。作者也对GNRs浓度与粒子间距分布的对应关系进行了统计分析,结果表明虽然D随着GNRs浓度的增加而减小,但间距参数在145nm处似乎达到一个饱和值。
作者也提到,本文报道的手性排列的GNRs与之前的一些报道不同,其中GNRs以端到端方式排列在超分子纤维上,因此在SPR吸收中表现出很强的等离子体耦合,因此PCD光谱显著拓宽。在这一结构中,由于粒子间距较大,相邻纳米棒之间间隙的局部场增强,即等离子体热点效应较弱。因此,由于纳米棒和靠近金表面的手性分子之间的电磁相互作用,局部场增强了PCD感应,因此可以确定PCD的产生主要是由GNRs排列的扭曲几何手性造成的。

图2、在界面上没有非对映体复合物对的超分子原纤维及其对gnr的模板手性排列的典型例子。(a)典型的扫描电子显微镜(SEM)图像(左)和结构特征(右)。(bc)LH/RH原纤维的ECD光谱。L-和D-GP-1的浓度分别为60μM和121 μM。(c)由LH纤维(左)模板的gnr排列的典型SEM图像(左)和粒子间分离的分布(右)。(d)从LH和RH纤维模板上的手性排列的gnr中分别获得的M型和P型PCD光谱,gnr浓度为80 pM。
接下来,作者研究了界面手性相互作用如何影响LH/RH原纤维的手性及其模板等离子体手性。半胱氨酸(L-/D-Cys)分子在这里被用作手性客体,与预制的LH或RH原纤维(手性宿主)相互作用,并通过FTIR光谱验证了GP-1与Cys之间的氢键相互作用。最终所产生的非对映体对,即LH-L/LH-D和RH-L/RH-D,可以通过可区分的ECD变化来识别(图3a)。与缺乏非对映体配合物相比(见图2b),从LH-L配合物中观察到ECD强度的降低(黑色实线,图3a),而从LH-D配合物中观察到CD强度的增长(黑色虚线,图3a)。从L-和D-Cys对RH原纤维的手性识别中可以观察到相反的行为:RH-D复合物的CD强度降低(红色虚线,图3a),而RH-L复合物的CD强度增加(红色实线,图3a)。这种ECD对超分子纤维手性识别发生的不对称行为之前已经被报道过,在这里,作者又进一步揭示了这种分子手性识别信息可以在等离子体手性中被转移和放大。在原纤维与Cys分子发生手性相互作用约30 min后,加入GNRs获得等离子体手性。
在原纤维与Cys分子发生手性相互作用约30 min后,加入GNRs获得等离子体手性。图3b显示了被检测到的PCD信号,它们显示了两个重要的特征:首先,M-/P- PCD保留了与LH/RH模板一对一的相关性(见图2d,不含非对映体配合物)。显然,非对映体配合物的存在并没有改变LH/RH模板的指导手性排列GNRs的偏手性的基本功能,其次,PCD对非对映体对(即LH-L/LH-D和RH-L/RH-D)的响应变化是不对称的,显示了ML/MD(PL/PD)信号强度的差异。具体来说,MD < ML是从LH原纤维形成的非对映体对中观察到,而PL < PD是从RH原纤维形成过程的得到。这些结果表明,在原纤维界面上的分子识别可以导致手性排列的GNRs的PCD响应的不对称放大。
除了原纤维与Cys分子之间的手性相互作用外,GNRs与氨基酸之间的相互作用也可以导致PCD的生成。为了检验后一种情况下对PCD的贡献,作者对Cys介导的GNRs端到端组装进行了对照实验(没有LH原纤维的参与)。在这一实验中,GNRs作为宿主直接与L-/D-Cys分子相互作用。在GNRs端到端组装过程中,PCD信号是由于GNRs与手性分子之间的场增强电磁相互作用而产生的。然而,与手性排列的GNRs的PCD相比(图3b),这种诱导的PCD响应明显不同,不仅表现出CD强度的减弱,而且具有不同的光谱轮廓。此外,还进行了一个对照实验,在加入Cys之前,在LH原纤维表面形成了手性排列的GNRs。在这种情况下,原纤维和纳米棒都可能是与客体分子相互作用的宿主候选者。添加L-和D-Cys诱导的PCD信号的变化显示出CD强度的不对称降低,而不是CD强度的不对称增长。综上所述,这些结果表明,原纤维和Cys分子之间的手性宿主-客体相互作用可能对图3b所示的不对称PCD扩增有主要贡献。
为了更好地理解不对称的PCD放大,用扫描电镜分析了非对映体对诱导的GNRs手性的几何变化排列。典型的扫描电镜图像是从由LH原纤维模板排列的手性GNRs中获得的(图3c),统计分析在LH-D和LH-L复合物的存在时GNRs手性排列情况表明,虽然非对映体复合物没有引起测量的GNR-GNR间距的变化,但他们确实引起了GNR-GNR扭转角度分布的明显变化(图3c,右)。当无非对映体配合物存在时,平均扭曲角θ0为~18°,相比之下,LH-L和LH-D配合物的存在使得GNRs之间产生了更大的扭曲角,统计显示θL和θD的平均值分别为(30±2)°和(27±2)°。平均扭曲角的变化,符合θ0 < θD < θL的关系,并与溶液相对应样品的不对称PCD扩增一致(M0< MD < ML,见图2d和3b)。同样,对于RH模板上的手性排列GNRs,平均扭曲角的变化遵循θ0 < θL < θD,也与从基于溶液的样品中观察到的不对称PCD扩增很一致(P0 < PL < PD)。
以手性GNR-二聚体为模型系统(插图,图3d),基于有限元方法(FEM),利用COMSOL进行了CD模拟。在此计算中,所使用的GNRs二聚体的几何参数来自于实验测量值。随着扭转角从18°增加到30°,PCD信号在峰值位置有轻微的变化,但PCD强度有明显的增长(图3d)。这些结果与实验观察结果一致,表明扭转角的增加对实验中放大的PCD信号有重要贡献。定性地说,由非对映体复合物引入的手性微扰,可以有效地改变手性GNRs排列中的扭曲角,从而能够通过不对称PCD读数检测分子的手性识别。因此作者提出了利用非对称PCD读数来识别上述分子手性的可能的物理过程。如图3e所示,螺旋原纤维与L-和D-氨基酸之间的手性识别可能导致原纤维模板的形态变化,这种手性识别在以前的报道中被发现可以引起超分子原纤维的宏观收缩。在这一体系中,作者也检测了LH或RH原纤维与80μM L-/ D-Cys分子的相互作用所引起的形态变化(螺距的不对称收缩)。在LH原纤维中观察到H0 > HD > HL的关系,而在RH原纤维中观察到H0 > HL > HD的关系。由于螺距的收缩,它可以引入原纤维缠绕的形态变化,并同时改变吸附在原纤维表面的纳米棒之间的扭曲角度(图3e),这样,不对称的螺距收缩就被转化为扭曲角度的不对称变化。
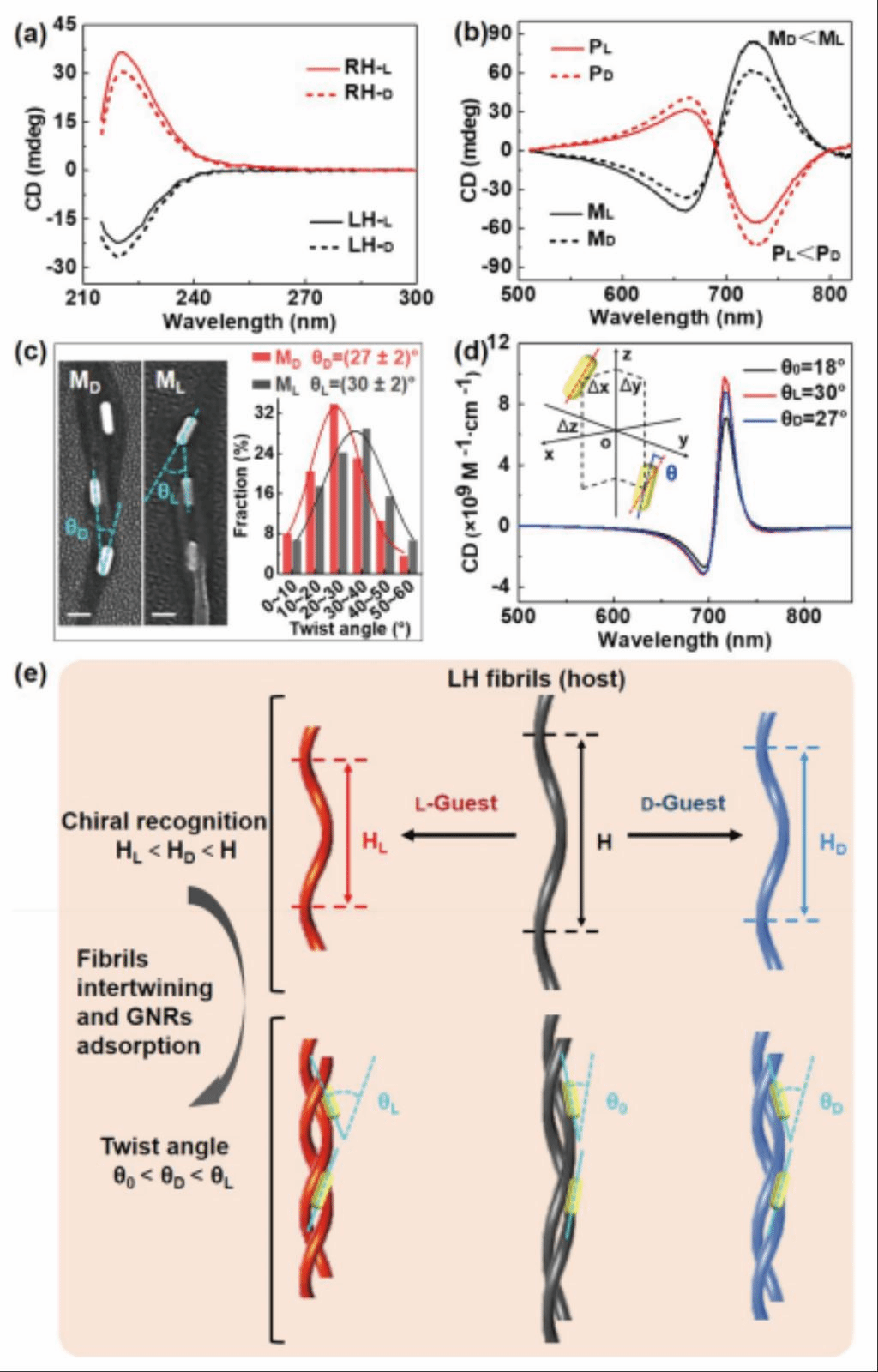
图3、由于界面上非对映体对的存在,对原纤维上的不对称扰动及其模板等离子体手性。(a和b)LH/RH原纤维与对映体对(L-和D-)Cys分子(80 μM)的手性识别引起的ECD和PCD光谱变化。(c)等离子体手性结构的几何变化的典型例子。(d)具有不同扭曲角的手性gnr-二聚体的CD模拟。(e)说明对映体氨基酸对诱导的手性扰动如何转化为手性gnr排列中扭曲角度的不对称变化,最终使不对称PCD读出用于手性识别的示意图。
作者利用不同的氨基酸进一步验证了不对称扩增PCD读数的手性识别检测(图4a)。以丙氨酸(Ala,30 μM)、青霉胺(Pen,50 μM)和脯氨酸(Pro,40 μM)的L-和D-对映体作为客体分子与LH/RH手性宿主相互作用,并用ECD与PCD测定了所涉及的手性转移和扩增。为了量化CD信号的不对称变化,作作者分别定义ΔCD(%)=ΔI/I0 =(I-I0)/I0×100%,其中I和I0分别为非对映体复合物存在和不存在条件下测量的CD强度。图4a显示了四种不同氨基酸的对映体对的归一化ΔPCD。它们都显示出与放大的PCD读数相同的不对称特征,即LH宿主的MD < ML,其中手性放大的PCD强度中D对映体的识别强度几乎是L对映体的一半。而RH宿主则则观察到相反的行为(PL < PD)。从不对称的PCD读数来看,四种氨基酸的对映体对可以被像荧光和ECD光谱等其他光学方法识别一样被鉴别。作者还进一步研究了不同浓度Cys分子手性识别的不对称ECD/PCD特征,在图4b中(LH宿主),在10-50μM范围内,ΔECD和ΔPCD值均随Cys浓度的增加呈线性增加。并且仍然能够在PCD扩增中观察到MD < ML和PL < PD的不对称特征。
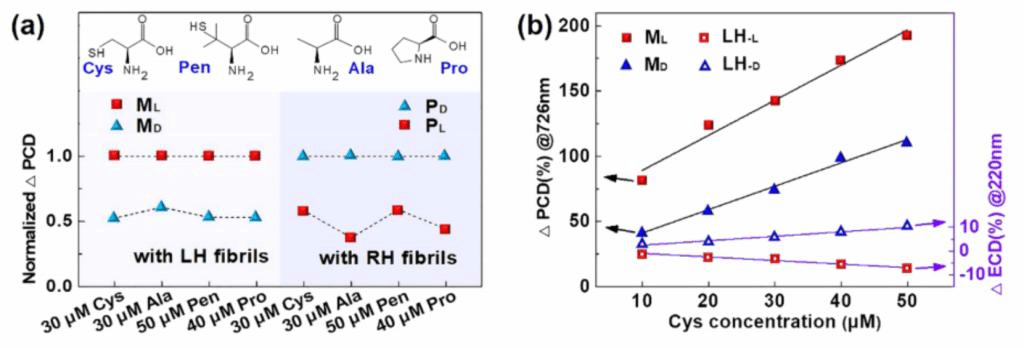
图4、通过不对称的PCD读数对四种不同的氨基酸进行对映体特异性识别。(a)氨基酸手性识别中显示的不对称PCD特征(MD < ML和PL < PD),相应的PCD峰强度在726 nm(Cys)、714 nm(Ala)、716 nm(Pen)和712nm(Pro)进行ΔPCD计算。(b)在10-50μM范围内,ΔECD和ΔPCD的峰值强度随Cys浓度的变化曲线图。黑色和紫色的实线是线性拟合,Pearson系数在0.98−0.99范围内。。
作者还进一步探索了基于PCD的手性传感对客体分子ee值的测定,对不同ee值下的LH/RH原纤维与Cys之间的手性相互作用进行了CD测量,其中ee值被定义为(XL-XD)/(XL + XD)×100%,其中XL和XD分别是混合物中两个相反对映体(XL + XD=1)。图5a显示了由LH/RH原纤维与多个ee值的Cys的手性相互作用测量到的PCD光谱,当没有手性相互作用的情况下(图5a中的黑色和紫色实线)相比,与不同ee值的客体手性分子产生相互作用时会放大了整个范围的PCD信号。通过对每个ee值下的ΔECD(220nm)和ΔPCD(726nm)分析,可以观察到ee从−1调整到1的s型的CD变化(图5a)。这个s型变化曲线显示出一个在-0.2≤ee≤0.2范围内急剧的增长的ΔPCD,然后缓慢增长,然后随着ee的增加而下降到更大的值(-1≤ee≤-0.2,0.2≤ee≤1)(图5b)。通过对这些PCD测量,可以确定ee值未知的Cys分子:例如,通过在−1≤ee≤1(间隔±0.2)处拟合Cys(总浓度为30 μM)的ΔPCD实验数据,得到了一个校准曲线,再结合ΔPCD的实验数据,可以得到D-/L-对映体在近外消旋范围内(-0.2≤ee≤0.2)的理论分数。在图5b中,ΔPCD和ΔECD中的非线性行为非常相似,这也证明了手性排列的GNRs中的PCD可以作为原纤维界面上手性识别的敏感探针。
此外,仔细对比ee=0(外消旋混合物)时CD的变化,其显示出了ee测量中的另一个重要特征。对于使用LH原纤维的情况(图5b),当ΔECD小于0.1%(蓝色虚线箭头)时,相应的ΔPCD可以高达110%(黑色虚线箭头)。这表明,在扩增的PCD中,通过手性作用(ee=0)到原纤维的手性信号,达到了巨大放大因子β(超过1000倍)。对于RH原纤维,也可以观察到同样的现象。对于每个ee值下的β,显示出显著的非线性变化曲线,如图5c所示,特别是当在近外消旋范围内(例如,−0.2≤ee≤0.2),β急剧增长,在ee = 0时达到最大值。这些结果表明,手性排列的GNRs和相应的扩增的PCD读数对外消旋和近外消旋区域的手性分析具有非凡的对映选择性和敏感性。这种对映选择性扩增的PCD也实现总浓度低至1μM的Cys分子的ee值测定。在这种情况下,由非对映体复合物导致的ECD变化一般很难获得,但可以清楚地观察到不对称放大的PCD信号(MD < ML,PL < PD,图5d)和ΔPCD的s型变化(在726nm处)。在不对称放大因子与Cys分子ee之间的相关性结果中再次观察到较强的非线性特征,如此高的氨基酸检测灵敏度远远超过了传统的基于ECD和荧光的检测方法。
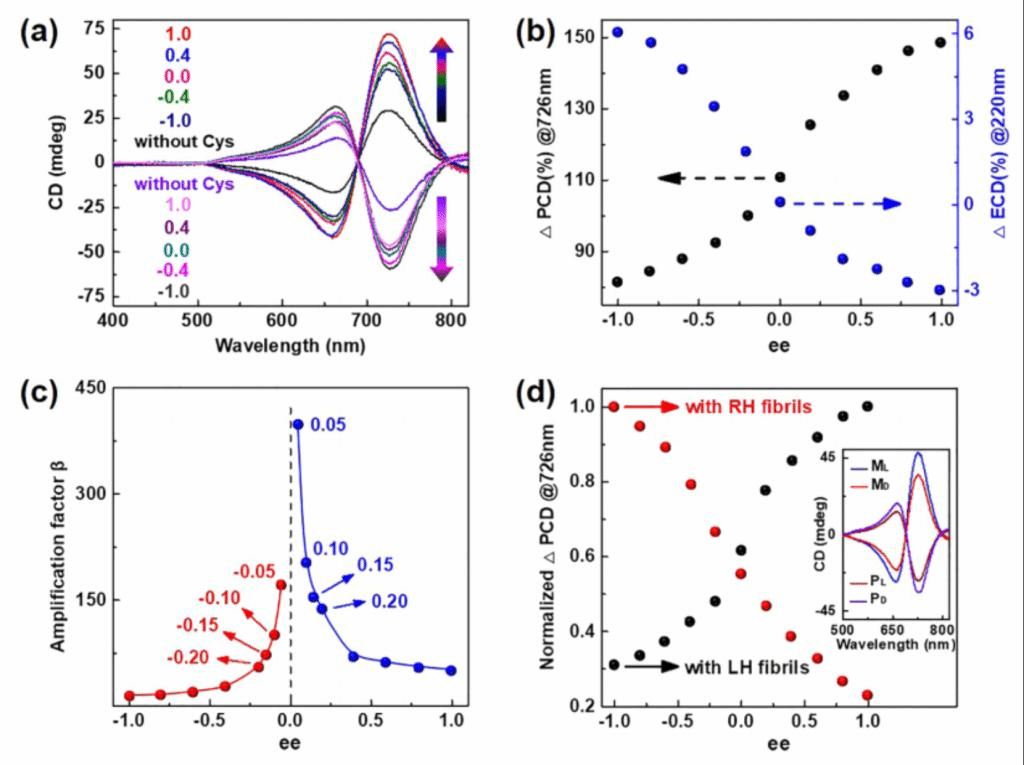
图5、用不对称放大的PCD读数定量测定不同ee%的Cys。(a)通过对LH和RH的原纤维的手性识别得到的PCD光谱,Cys(30μM)ee%从-1到1范围调控。(b)在使用LH原纤维的情况下,ΔECD和ΔPCD的峰值强度作为ee的函数的变化图。(c)在使用LH原纤维的情况下,扩增因子β作为Cys(30μM)ee的函数图。(d)对于使用LH和RH原纤维时,在检测浓度为1 μM的L-和D-Cys时观察到不对称放大的PCD信号(插图),它们的峰值强度ΔPCD(归一化)与Cys的ee的变化。
综上所述,作者展示了一个基于PCD的分子手性分析的手性光学平台。它基于手性等离子体纳米传感器的设计,可以将手性宿主-客体识别的信息转化为不对称放大的PCD读数。这一方法的特点是对溶液相纳米界面分子对映选择性识别的敏感性和特异性。作者推测,在主-客体相互作用的影响下,手性排列的GNRs对原纤维缠绕和GNRs-原纤维相互作用的几何敏感性可能对PCD探测的敏感性起到重要作用。然而,要进一步了解在原纤维界面上发生的手性相互作用如何转化为手性排列的GNRs中扭曲角的变化,还需要在分子水平上进行更深入的研究。值得注意的是,原纤维的横向尺寸与单个GNR的大小相当,而相互缠绕的原纤维对纳米级界面上的氢键介导的手性相互作用非常敏感,这是获得良好的氨基酸手性识别性能的两个先决条件。此外,作者基于PCD的手性传感平台只需要两个基本组件,即GNRs和自组装的超分子原纤维。虽然作为敏感等离子体纳米传感器的GNRs已经被证实,能够与生物分子产生氢键相互作用的超分子原纤维已被广泛使用。基于此,本文报道的体系可以为识别手性有机分子提供更为广泛的基底,并且可能会在生物技术特别是制药工业中具有重要的价值。
文字 郗盼毅
审核 叶曦翀
参考文献:DOI: 10.1021/acsnano.1c06467
https://pubs.acs.org/doi/full/10.1021/acsnano.1c06467