Angew. Chem. Int. Ed. | 通过界面自组装制备手性硒化物纳米膜并用于对映体特异性识别
今天与大家分享一篇发表在Angew. Chem. Int. Ed.上的文章,标题是“通过界面自组装制备手性硒化物纳米膜并用于对映体特异性识别”。本文的通讯作者为江南大学国家粮食质量安全生物快速检测技术创新中心徐丽广教授。
由于具有对映体构型的手性分子通常在生理活性上差异很大,例如L-kynurenine (L-Kyn)可以对炎症、肿瘤、代谢系统和精神系统等产生影响,特别是对精神系统疾病有明显作用,因此对于对映异构体的定性鉴别和定量检测在生命化学和医学领域具有重要意义。多种光谱检测方法已被开发出来用于对映体的定量分析,包括圆二色(CD)光谱。
通过将纳米颗粒大规模组装成薄膜而得到纳米膜。纳米膜作为一种人工通道可为离子传递提供一个受限的环境从而有效地放大传输信号。而且,光信号探测具有非侵入性和动态调控的优势。并且传输信号可以通过光激发来进一步放大。手性纳米材料在手性光子学和手性传感等一系列快速发展的器件中引起了人们极大的兴趣,并且由于其独特的内在特性仍表现出对映选择性。手性纳米膜具有优异的稳定性、可控的孔结构和特殊的表面特性,可以实现更高的官能团密度,并为目标分子提供更多的手性接触点。
本研究制备了一种对对映体具有高灵敏度的手性纳米膜。该手性纳米膜由L-/D-半胱氨酸(L-/D-Cys)通过界面组装技术修饰的有序手性硒纳米粒子(Se NPs)组成,具有较高的光感应电流并具有手性识别性能。10层D-纳米膜产生的光电流为39.53±1.43 nA, L-Kyn的检出限(LOD)高达0.0074 nM。最后,在一系列临床样本中对这种对映体特异性检测技术进行了测试。
为了制备手性Se NPs(方案1a),用硼氢化钠(NaBH4)还原二氧化硒(SeO2)得到零价Se NPs,然后用L-Cys、D-Cys或DL-Cys稳定Se NPs,分别记为L-Se NPs、D-Se NPs、DL-Se NPs。L-Se NPs和D-Se NPs的直径几乎相同,都为50±3.5 nm(图1a),表现为形态规则。高分辨率透射电子显微镜(HRTEM)图像显示,晶格间距为2.98±0.1 Å,对应于六边形Se相[101]平面(图1c)。x射线衍射(XRD)谱图与六方Se相一致(图1f)。
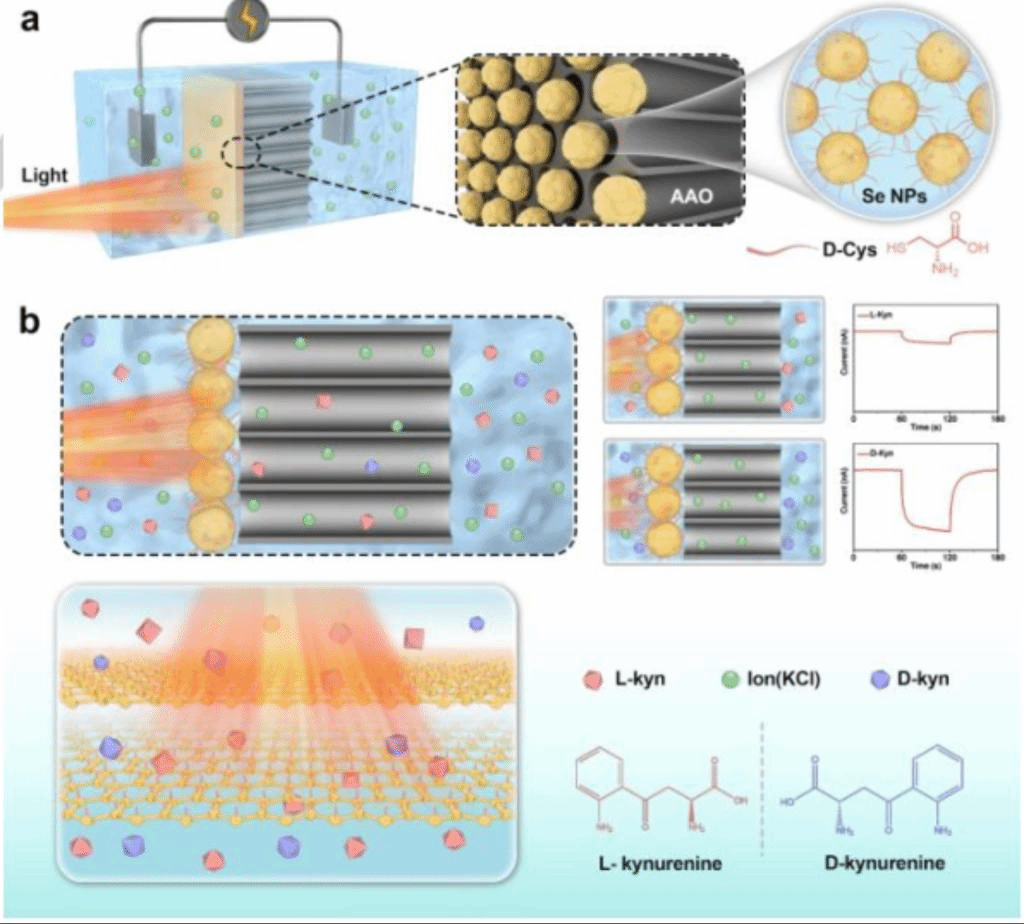
方案1 (a)光照下离子输运示意图。(b)光照下对映体对D-Cys 传感膜上的对映选择性识别作用。精确的纳米膜结构和通过D-Cys插层控制具有所需功能的硒纳米孔尺寸策略。
EDX能谱证实了NPs的组成,表明存在Se和S(图1d)。手性Se NPs在液-液界面组装成NP单层,然后使用朗缪尔—布洛杰特(Langmuir-Blodgett技术)转移到AAO无机膜或载玻片上进行电化学或光学测量。扫描电镜(SEM)图像显示,纳米膜的横截面和表面呈均匀的层状微观结构(图1e),密集排列的NPs形成离子通道,可用于离子传输。D-NPs和L-NPs在388 nm、446 nm和641 nm处分别表现出接近39.96 mdeg、13.09 medg和19.03 mdeg的圆二色(CD)峰,发光不对称因子glum分别为0.0013±0.0001、0.00078±0.00003和0.004±0.0002(图1b),这可能与分子和纳米粒子水平上的手性转移有关。
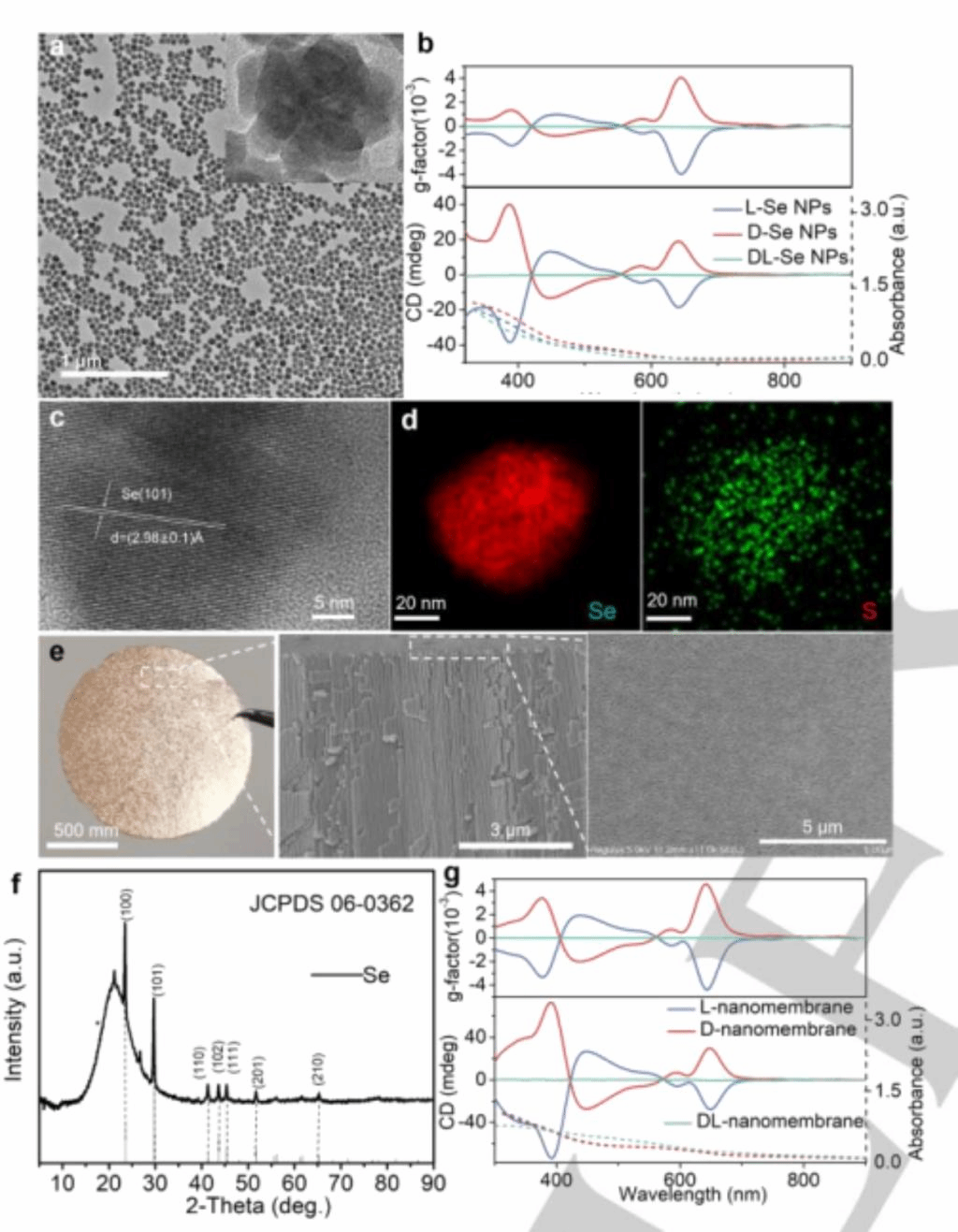
图1 (a) D-Se NPs的透射电镜(TEM)图像(b) L-Se NPs、D-Se NPs、DL-Se NPs的CD、UV-vis和g因子光谱(c) HRTEM图像(d) D - Se NPs图。(e)结构特征D-Se纳米膜的结构膜照片的直径左边是14毫米。SEM图像上的Se-AAO纳米通道的横截面(中)。单层D-Se-NP纳米膜的SEM图像(右)。(f)D-Se纳米膜的XRD谱图。(g) CD、UV-vis和g因子光谱。
硒原子和半胱氨酸的吸附过程可以通过空间分布函数(SDF)模拟可视化。结果表明,L-Cys吸附硒原子,硒原子以偏转向外延伸的方式生长;D-Cys吸附硒原子,硒原子以平衡向外延伸的方式生长。与单个NPs不同,NPs纳米膜的发光波长发生红移,在391 nm处表现为72.8 mdeg,在449 nm处为27.34 mdeg,在648 nm处为29.81 mdeg,g因子分别为0.0034±0.0002,0.0020±0.0001和0.0046±0.0002(图1g),这是由于Cys的分子尺度手性与高度填充的纳米膜中的间隙手性耦合所致。
纳米膜中光电流的产生
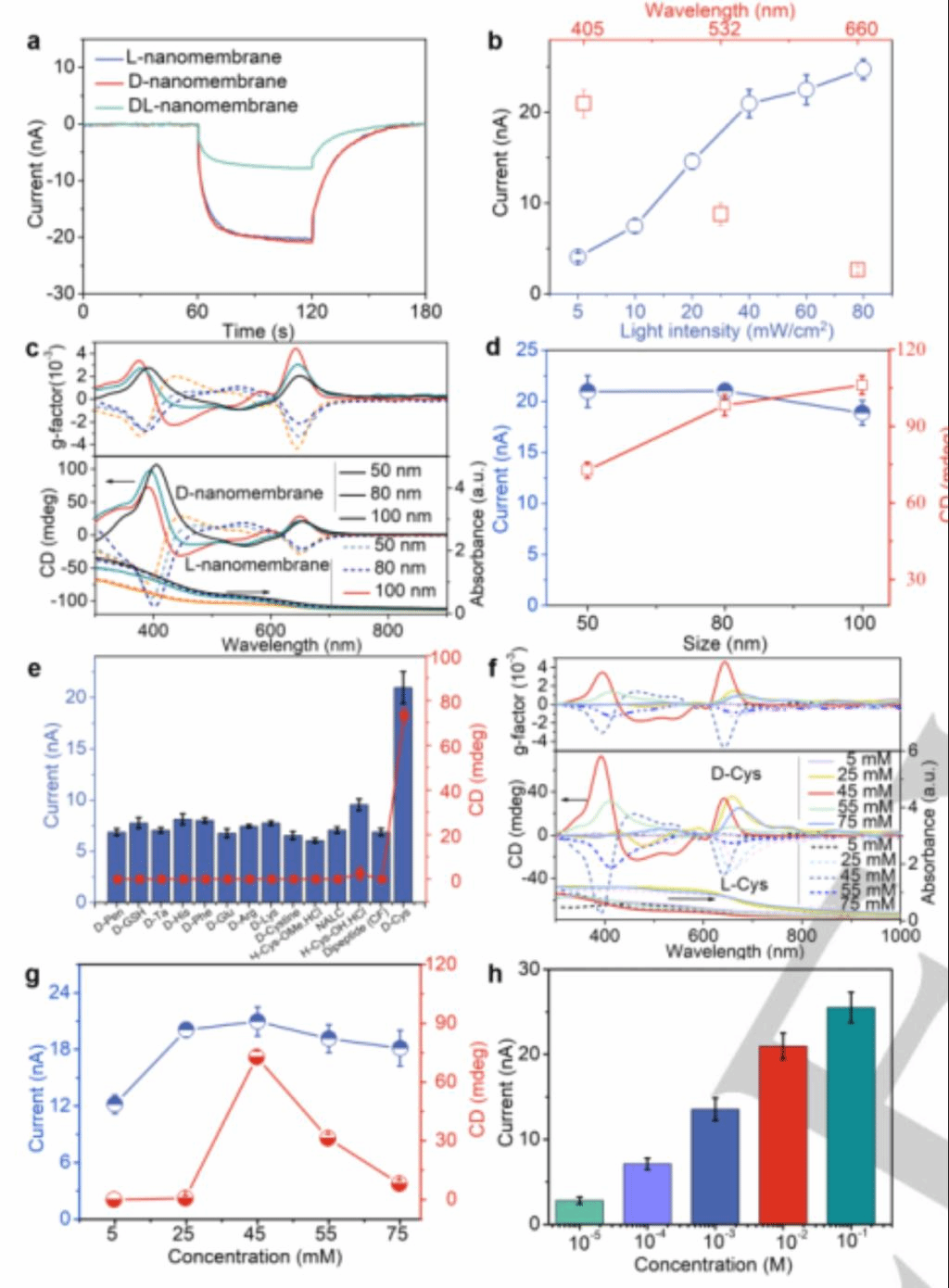
图2 (a)光敏器件上光电流的时间分布用L-Se NPs、D-Se NPs、DL-Se NPs制成纳米膜。(b) D-Se纳米膜上的光电不同的照明波长(红色)和不同的照明强(蓝色)。(c)不同尺寸的D-Se NPs的CD、UV-vis和g因子光谱。(d)D-Se纳米膜的CD振幅(红色)和离子电流值(蓝色)由不同大小的D-Se NPs组成。(e) CD幅值(红色)和离子电流值(蓝色)为不同手性配体的硒纳米膜。 (f)不同改性硒纳米膜的CD、UVvis和g因子光谱L/D-Cys浓度。(g)带NPs的CD振幅(红色)和I值(蓝色)在不同浓度的D-Cys下进行修饰(h)光电流通度不同浓度KCl对纳米膜的影响。
在405 nm(40 mW/cm2)孔径为3 mm的有机玻璃电池中测量光电流(I),即光驱动离子在纳米膜上的传输。图2a显示了在黑暗和405 nm(40 mW/cm2)辐照度下测量的纳米膜的光电流。L-NPs和D-NPs纳米膜的IL分别为20.58±1.36 nA和20.97±1.55 nA。DL-纳米膜在光照下离子电流非常微弱或是没有变化,这是由于纳米膜中的间隙与电解质离子的德拜长度相互作用使得孔径较大的DL-纳米膜表现出较弱的离子电流。
光电流的大小取决于照明的功率、时间和波长。由于I值最高(图2b),后续实验采用最优波长405 nm照明,这与Se纳米膜的吸光度一致(图1g)。数据表明,当辐照度达到60 s (80 mW/cm−2)时,ID达到最大值24.74±1.12 nA,进一步证实了光驱动离子电流产物。与其他尺寸的纳米颗粒(如80 nm和100 nm)相比,由于具有高分散性的尺寸为50±3.5 nm的纳米颗粒所形成的纳米膜具有更高的I值(20.97±1.55 nA)(图2c)。因此,选择50±3.5 nm的NPs作为后续研究的最佳尺寸。
手性依赖性光电流响应
与其他配体如D-青霉胺(D-Pen)、D-谷胱甘肽(D-GSH)、D-酒石酸(D-Tar)、D-组氨酸(D-His)、D-苯丙氨酸(D-Phe)、D-谷氨酸(D-Glu)、D-精氨酸(D-Arg)、D-赖氨酸(D-Lys)、D-半胱氨酸、L-半胱氨酸甲酯盐酸盐(H-CysOMe.HCL)、N-乙酰- L-半胱氨酸(NACL)、L-半胱氨酸盐酸盐水合物(H-Cys-OH HCl)和二肽(半胱氨酸苯丙氨酸,CF)等稳定修饰的Se纳米膜相比,D-Cys修饰的Se单层纳米膜具有最高的CD峰(72.8 mdeg)和20.97±1.55 nA的良好光电流响应。实验数据表明,上述13个相似的表面配体CD峰接近于零,与Cys修饰的纳米膜相比,I值小了2倍以上(图2e)。这是因为这些纳米颗粒的大小和形状不规则,不利于密闭环境中离子的选择性运输。添加不同配体后Se NPs的形状差异还可能与还原Se的性质有关。
具体来说,使用含有巯基的Cys有利于诱导Se和Cys之间的相互作用。在使用Pen时,由于Se和Pen之间的相互作用较弱导致无法成功得到纳米膜。Cys-Se纳米膜往往具有确定的结晶度,规则均匀的形态(图1e,f)。SEM图像中没有观察到缺陷(图1e),证实了Cys-Se单层纳米膜的质量非常高。因此,作者团队将Cys作为最优配体进行进一步分析,测试了的Cys不同浓度(图2f)。随着D-Cys浓度的增加,CD峰的振幅在391 nm处从0增加到72.8 mdeg,在浓度为45 mM时达到饱和CD峰,浓度超过55 mM时CD峰发生显著下降。光响应电流I的变化趋势与纳米膜的CD振幅一致可以表明纳米膜的最佳分子浓度,45 mM时 D-Cys的光响应电流为20.97±1.55 nA。作者期望可以看到I振幅值、CD光谱和浓度依赖性之间的线性关系。
对手性NPs的形貌也进行研究,TEM数据显示被D-Cys修饰的Se NPs具有花状结构(图1a)。不同Cys浓度的Se NPs光电流响应如图2g所示,Cys浓度大于55 mM时纳米粒子呈现棒状和不均匀的大粒径,产生较低的光电流。这是由于纳米通道中不同的孔隙环境,包括离子输送通道的大小和形状所导致的。在45 mM Cys条件下,形貌均匀且尺寸较小的Se NPs具有最高的I值和CD强度,更短的离子传输通道促进了离子传输。其他13个配体产生的较弱的I值和CD强度证实了产生的光电流和手性取决于表面形貌。
光和物质在纳米膜中的相互作用也会影响离子气氛和离子输运。当膜周围电解质(KCl)浓度接近0.01 mM时,未观察到明显的光电流。随着电解质浓度的增加,I随KCl从0.1 mM增加到100 mM,并在100 mM时达到饱和(图2h),这与预期的离子通量一致。Se中分离的电子和空穴产生了离子输运的光伏动力。
硒纳米膜的对映选择性识别
为了探究手性纳米膜的对映体选择性识别,作者以L-Kyn和D-Kyn对映体为靶分子。具有手性的犬尿氨酸广泛应用于炎症、免疫反应和兴奋性神经传递。D/L-Kyn对映体与D-纳米膜相互作用时产生明显的光电流变化,L-Kyn的光电流从20.97±1.55 nA降低到3.58±1.63 nA,D-Kyn的光电流从20.97±1.55 nA降低到20.38±1.48 nA(图3a)。与此相对的是,L型纳米膜则呈现相反的识别能力(图3b)。进而表明,手性硒纳米膜的对映选择性识别不仅使该系统在混合体系中仍具有高灵敏的对映选择性识别,同时也可在临床样本中定量选择性识别和检测。
此外,作者团队还选择了多种手性配体,包括谷氨酸(Glu)、组氨酸(His)、苯丙氨酸(Phe)、二肽(苯丙氨酸-半胱氨酸,CF)、青霉胺(Pen)和半胱氨酸(Cys)来验证特异性。实验表明,Cys是一个合适的配体,制备的Cys-Se膜对L/D-Kyn具有对映选择性识别能力(图3c)。用45 mM Cys修饰的50 nm Se NPs通过单层纳米膜的光电流达到5.69倍,在405 nm (40 mW cm - 2)的光照下,L-Kyn和D-Kyn的识别差异最大(图3d)。
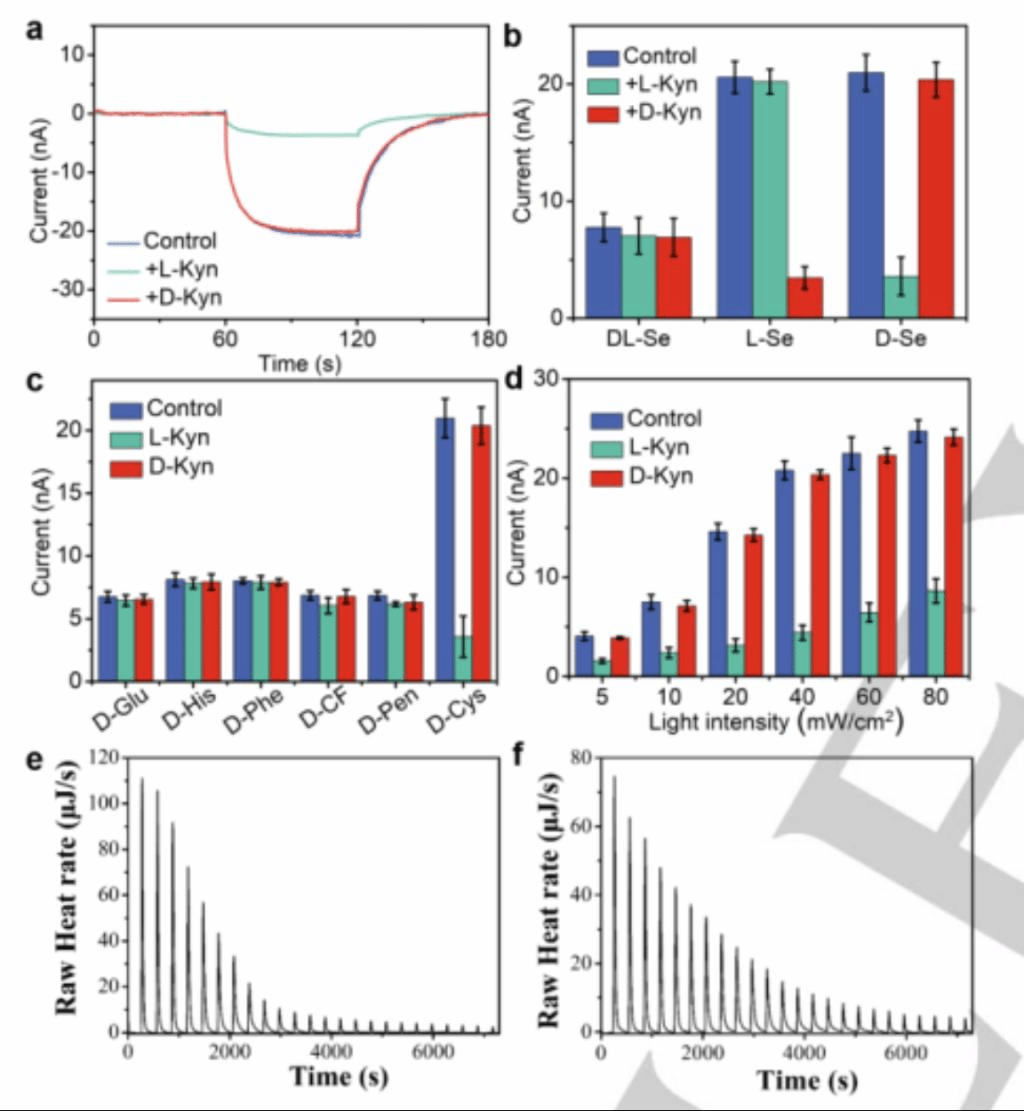
图3 (a)单层D-Se纳米膜的光电流变化L/D-Kyn的加入。(b) D-Cys、L-Cys、DL-Cys纳米膜在添加和不添加Kyn时的光电流变化。(c) L/D-Kyn加入后比较不同配体在硒纳米膜上的光电流。(d)来自Se的光电流比较不同光强的纳米膜。(e)含L-Kyn的D-Se的ITC数据。(f)含D-Kyn的D-Se的ITC数据。
为了探究纳米膜手性识别机制,基于三点相互作用”(Three-point interaction)理论,对映选择性识别是基于犬尿氨酸对映体和手性硒纳米粒子之间结合特性的差异而完成的。相互作用涉及通过手性中心的三个侧基形成的基底键合,这可能导致吸附方式和能量上的显著对映体差异。采用等温滴定量热法(ITC)研究了D-Cys Se NPs对溶液中D-Kyn/L-Kyn的手性识别性能。D-Cys Se NPs对L-Kyn的亲和常数比D-Kyn的亲和常数大100倍,亲和常数Ka分别为5.346×107 M-1和3.608×105 M-1(图3e)。
定量手性传感
通过将Se NP单层转移到AAO衬底上,制备了多层纳米膜。从单层增加到三层,CD强度显著增加,3层纳米膜时达到232 mdeg(图4a),光电流达到26.26±2.56 nA;当L-Kyn的光电流比D-Kyn低8.64倍时,识别效果更好(图4b和图4c)。采用10层手性纳米膜的光响应膜研究了手性对映体Kyn的识别。分析表明,使用10层 D-Se纳米膜时,当L-Kyn浓度从10-8 mM增加到10-1 mM时,离子电流从39.53±1.43 nA线性下降到4.51±1.87 nA;当D-Kyn浓度从10-8 mM增加到10-1 mM时,离子电流从39.53 nA±1.43 nA线性下降到38.98±1.65 nA(图4D和4e)。建立Kyn浓度与光驱动离子电流信号强度之间的线性校准曲线用于L-Kyn的检测。当使用10层 D-Se纳米膜时,L-Kyn的检测限(LOD)为0.0074 nM(图4f),灵敏度水平比以前报道的方法高10倍。
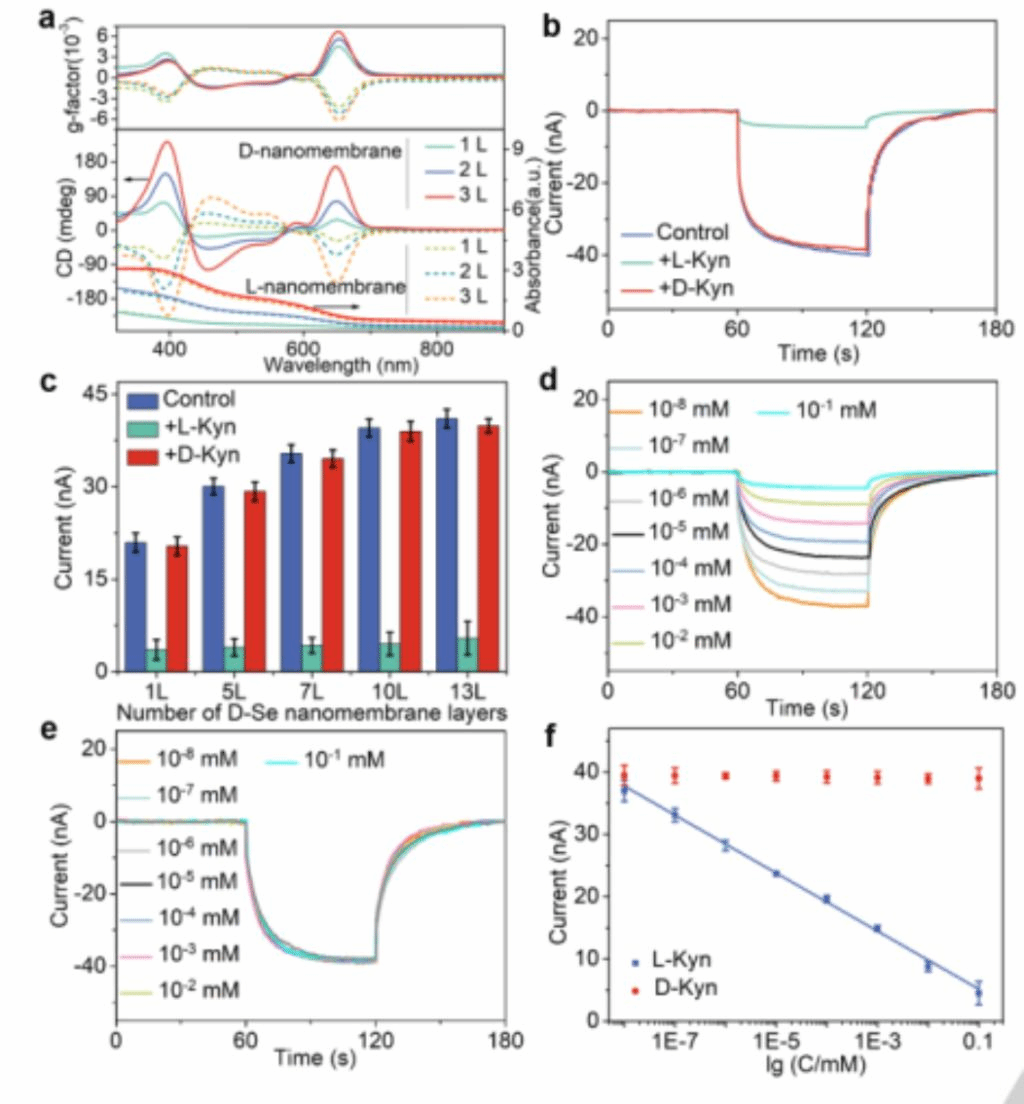
图4 (a) 不同层 L/D-Se纳米膜的CD、UV-vis和g因子光谱。(b)添加Kyn前后的10层硒纳米膜的I-t曲线。(c) 在添加Kyn前后1-13层D-Se纳米膜的光电值(d) 不同L-Kyn浓度的10层D-Se纳米膜I−t曲线。(e) 不同L-Kyn浓度的10层L-Se纳米膜I−t曲线。(f) 10层Se纳米膜的D-/L-Kyn标准曲线。
研究了手性纳米膜在相同条件下连续10次循环的可重复使用性。离子电流未见变化(图5a)。在特异性测试中,苯丙氨酸(Phe)、丝氨酸(Ser)、天冬氨酸(Asp)、谷氨酸(Glu)、组氨酸(His)和葡萄糖(Glc)对映体以及混合溶液(Phe、Ser、Asp、Glu、His、Glc、Cys)的光响应电流值较低,未观察到对映选择性识别(图5b)。这些数据表明,L/D-Kyn两种对映体都表现出选择性区分对映体的能力。为了研究十层D-纳米膜的检测性能,作者团队分析了阿尔茨海默病(AD)患者和健康受试者的血清和脑脊液(CSF) (n = 7)临床人类样本的L-Kyn水平。健康人血清中L-Kyn浓度为1.01±0.27 mM,阿尔茨海默病患者血清中L-Kyn浓度为1.56±0.45 mM,两组脑脊液中L-Kyn浓度分别为0.12±0.053 mM和0.17±0.045 mM(图5c和5d),表现出更高的灵敏度,因此能够监测临床样品中的Kyn。统计分析显示,AD患者的L-Kyn浓度高于健康受试者(图5c、d),这与之前报道中的结论是一致的。
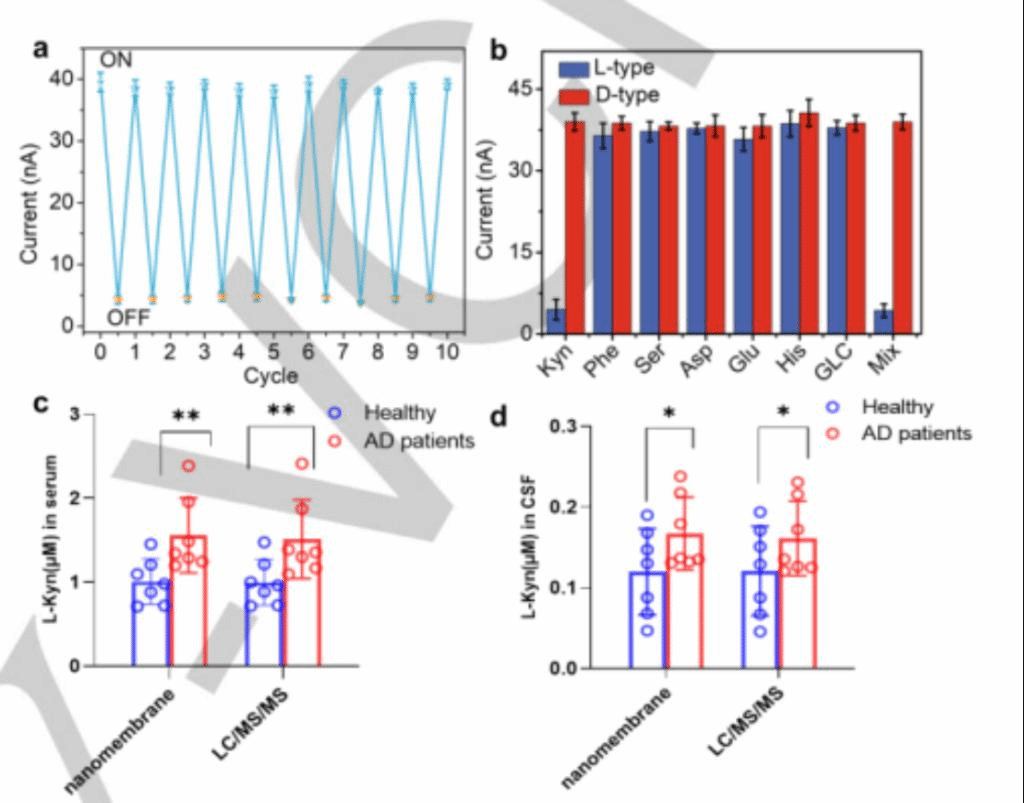
图5 (a)修饰纳米通道的可重复使用性。(b)Kyn检测对其他对映体的选择性。(c, d) L-Kyn健康人与阿尔茨海默病患者血清和脑脊液中的水平(n = 7)。
L-Kyn在多种病理生理过程中发挥特定的调节作用。对Kyn的高灵敏度、高特异性检测具有重要意义,可为早期诊断和干预提供准确依据,加深对病理和治疗的认识。该研究提出了光驱动离子传输的手性硒纳米膜的设计和构建,在对映选择性识别的应用中表现出高的灵敏度,实现在临床样本中的定量选择性识别。为开发用于生物医学科学的多功能手性纳米膜提供了一条新途径。利用这一策略,作者团队期望未来将开发出更多基于NPs的人工离子通道。
文字: 王诺
审核: 叶曦翀
参考文献:DOI: 10.1002/anie.202311416
https://doi.org/10.1002/anie.202311416