Small | 具有确定手性微环境的沸石咪唑酯骨架材料用于电化学手性识别
今天与大家分享一篇发表在Small上的文章,标题是“具有确定手性微环境的沸石咪唑酯骨架材料用于电化学手性识别”。本文的通讯作者为南京大学化学化工学院夏兴华教授。
手性分子,例如氨基酸、糖、蛋白质和各种核酸被看作是生命体的重要基本组成。这些手性分子的不同对映体在大多数无生命环境中表现出相同的物理化学性质,但它们在生化系统中的表现却可能出现显著差异。由于生物体内的受体或酶是手性的,往往只有一种对映体药物能够与其选择性地作用产生而效果。因此,手性分子的精确识别和分离对于它们的实际应用非常重要。虽然由于两种对映体的极端相似性,手性识别一直是一个挑战。但随着新型手性识别材料的出现,如上转换纳米颗粒、手性纳米结构金膜、手性柱芳烃和手性硒化铜纳米颗粒等,手性识别技术在过去几十年取得了巨大的进步。然而,它们的性能还远远不能令人满意,这主要是由于目前仍缺乏对手性识别机制的理解和对手性环境精确调节的能力。
基于此,作者制备了单一手性沸石咪唑酯骨架材料(c-ZIF) 修饰的纳米通道器件,c-ZIF-8层被电化学沉积在涂有金膜(Au-PET)的聚对苯二甲酸乙酯纳米通道阵列的一侧,形成了手性识别器件,称为c-ZIF-8- PET。该器件为电化学手性识别提供了一个理想平台。基于“三点相互作用”(Three-point interaction)理论,手性识别通常是靠两个对映体和手性结合位点之间相互作用的差异而完成的。然而,由于忽略了手性环境的影响(例如受限的纳米空间和邻近基团),对其手性识别能力几乎无法预测。因此,制备结构明确、手性环境可调的单一手性材料,对进一步完善对手性识别机制的理解具有重要意义。作者团队通过比较该膜对色氨酸(Trp)、丙氨酸(Ala)和亮氨酸(Leu)三种不同大小的手性氨基酸的电化学反应,揭示了手性分子与手性腔尺寸匹配因素对手性识别的影响。进一步通过将醛基引入手性MOF腔,揭示了邻近基团这一手性环境因素对手性识别的影响。
本研究的具体工作如下:作者首先使用阴极沉积法制备c-ZIF-8-PET膜,将ZIF-8和c-ZIF-8层沉积在Au-PET上(图1)。当在金膜上施加-0.13 mA cm−2的恒电流密度时,靠近电极表面的水分子被还原,产生氢气和OH−负离子,由此在靠近金电极表面的地方创造了一个碱性环境。
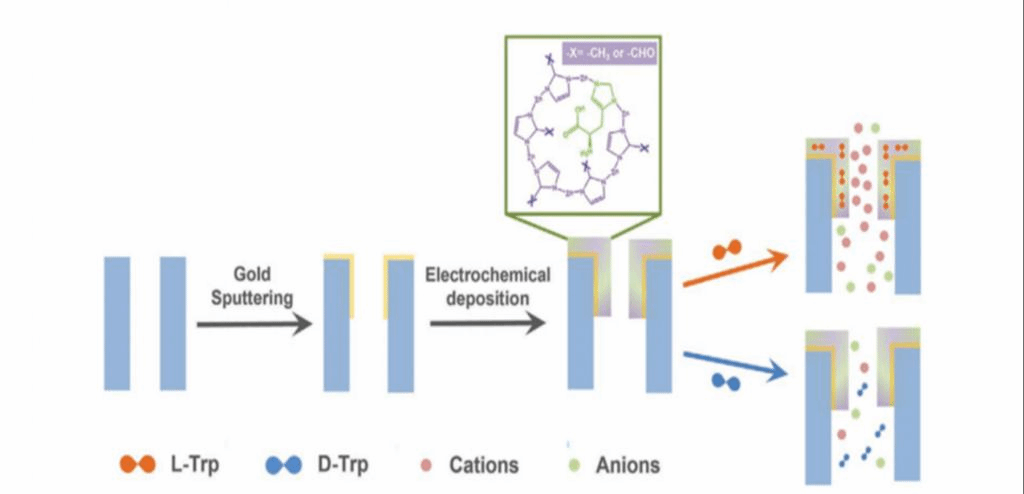
图1、c-ZIF-8-PET膜的制备和手性识别过程示意图。
然后,2-甲基咪唑配体去质子化,与邻近的迁移到金表面的Zn2+离子配位,在连续电解的条件下形成致密的ZIF-8层。前驱体溶液中存在与2-甲基咪唑配体具有相同咪唑基团的手性L -组氨酸(L-His)分子,手性分子与c-ZIF-8的结合改变了纳米通道的表面电荷密度,导致了跨膜离子电导率的变化,因而利用这种电化学方法合成的c-ZIF-8-PET手性复合膜可用于手性识别。
之后用扫描电镜(SEM)对合成的ZIF-8-PET和c-ZIF-8-PET膜进行表征。与纯Au-PET相比,ZIF-8和c-ZIF膜沉积4小时导致PET纳米通道尺寸从300 nm减小到250 nm。ZIF-8和c-ZIF-8层都紧密附着在金膜上,厚度约为200nm(图2a)。Zn和N元素的均匀分布进一步揭示了沉积在Au-PET膜上的c-ZIF-8层的均匀性。接触角确定为35.3°(图2b),远小于ZIF-8层的接触角。
作者将这种亲水性主要归因于在结构中引入了L-His配体。c-ZIF-8的x射线衍射(XRD)图与ZIF-8一致(图2c),表明c-ZIF-8与ZIF-8具有相同的SOD拓扑结构。通过测量ZIF-8和c-ZIF-8的傅里叶红外变换(FTIR)和X射线光电子能谱(XPS)进一步证实了手性L-His在MOF结构中的存在。与ZIF-8相比,c -ZIF-8在1645 cm−1处出现了一个新的红外吸收峰(图2d),这是由于L-His中羧基(−COOH)的C = O振动所致。c-ZIF-8的手性也通过其圆二色(CD)光谱在234 cm−1处的吸收峰得到证实,这在ZIF-8中没有观察到(图2e)。ZIF-8和c-ZIF-8的多孔性通过N2吸附/解吸等温线的典型I型特征的出现得到了证实。这些结果证明了c-ZIF-8的成功制备和手性L-His配体的引入。
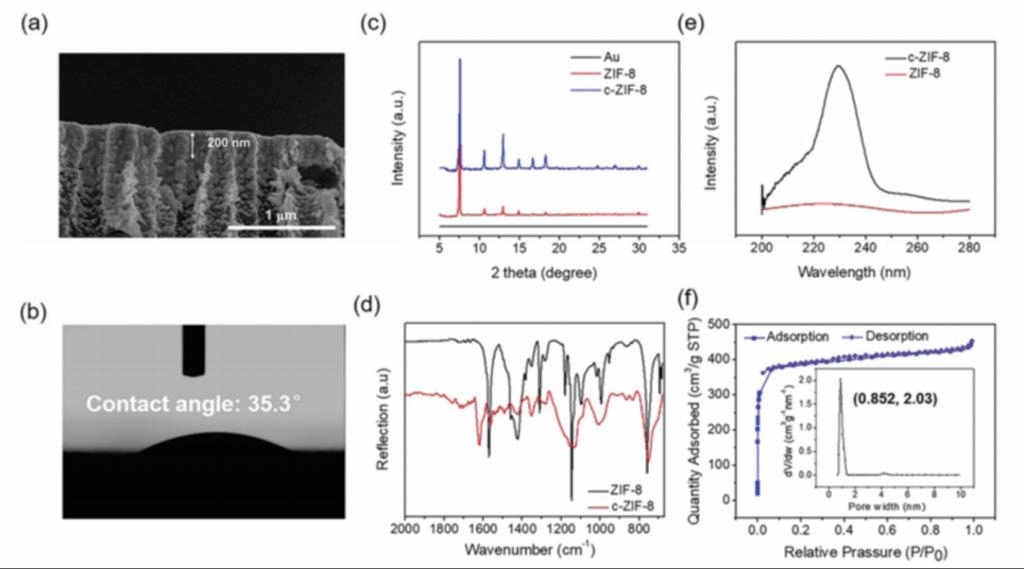
图2、c-ZIF-8-PET的表征。a) c-ZIF-8-PET膜的SEM横截面图。c-ZIF-8层厚度为200 nm。b) c-ZIF-8层接触角。c)镀金Si衬底上ZIF-8(红色曲线)和c-ZIF-8(蓝色曲线)层的XRD谱图。黑色曲线表示Au-Si衬底的XRD谱图。d) ZIF-8(黑色曲线)和c-ZIF-8(红色曲线)的FT-IR光谱。e) ZIF-8(红色曲线)和c-ZIF-8(黑色曲线)的CD光谱。f) c-ZIF-8的氮气吸附-解吸等温线及孔径分布曲线。
之后为了研究c-ZIF8-PET膜的手性识别性能,作者团队利用两个Ag/AgCl电极将c-ZIF8-PET膜安装在两个半电池之间,施加跨膜电压偏置。跨膜电导-浓度曲线显示,在低浓度(< 1 mm)溶液中,离子传输受表面电荷控制,这是手性识别的重要依据。在进行手性识别实验时,由于pH值低于10时c-ZIF-8结构在长时间测量过程中可能会缓慢断裂,因此使用0.1 mm KOH作为支撑电解质。首先用KOH溶液填充半电池,然后逐步加入浓缩的手性分子溶液。添加L-Trp后,c-ZIF-8-PET的电流-电压(I-V)曲线变得更加陡峭,而添加D-Trp后则基本保持不变(图3)。相比之下,ZIF-8-PET对D-Trp或L-Trp均无反应(图3b)。为了定量评价c-ZIF-8-PET的手性识别性能,计算+1 V时电流增加到基极电流的电流增加比例(r),r=ΔI/ I0,其中ΔI为加入手性分子后增加的电流,I0为空白KOH溶液中测量到的基极电流。如图3c所示,c-ZIF8-PET的rL−Trp几乎随L-Trp浓度的增加而线性增加,在333µm处达到0.56。而rD -Trp在加入D-Trp后几乎保持不变。进一步计算选择性(ηL/D) 以评估一种对映体(L-色氨酸)对另一种对映体(D-色氨酸)的手性选择性,其中ηL/D定义为rL−Trp/rD -Trp。由图3d(实线)可知,随着色氨酸浓度的增加,c-ZIF-8-PET的ηL/D先增大后略有减小,在33µm处达到最大值8.2。相反,对于非手性ZIF-8-PET,无论在支撑电解质中加入L-Trp还是D-Trp,r值都接近于0(图3c,虚线);而ηL/D值接近于1(图3d,虚线),无手性选择性。这些结果证明了c-ZIF-8-PET对Trp对映异构体的识别能力。
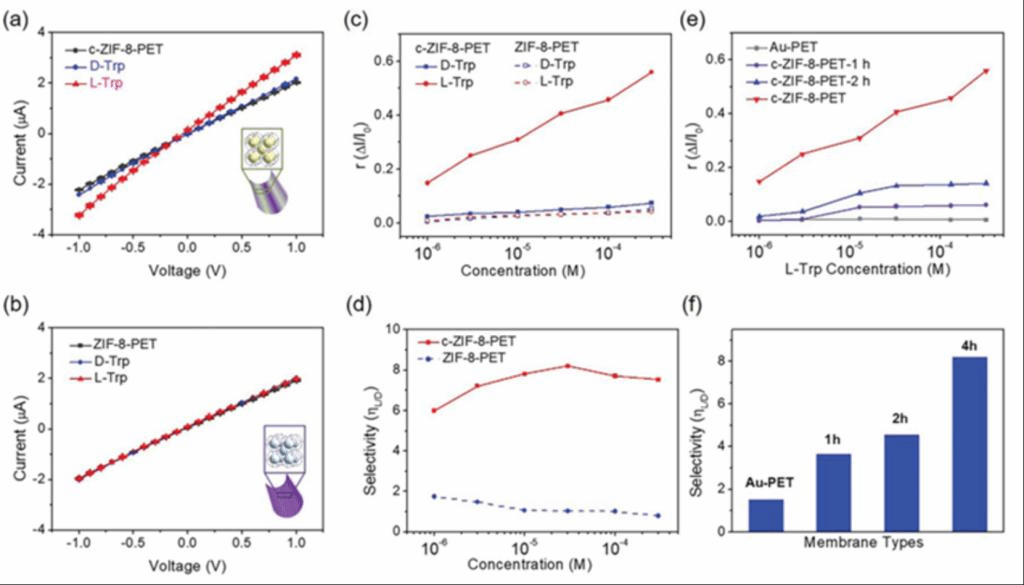
图3、c-ZIF-8-PET的手性识别性能。a)添加D-Trp或L-Trp前后在0.1 mm KOH中c-ZIF-8-PET的I-V曲线。b)添加D-Trp或L-Trp前后0.1 mm KOH中ZIF-8-PET的I-V曲线。(a)和(b)中D-或L-色氨酸的最终浓度为333µm。c) c-ZIF-8-PET和ZIF-8-PET增加电流比例(r)随色氨酸浓度的变化。d) c-ZIF-8-PET和ZIF-8-PET的手性选择性(ηL/ D)随色氨酸浓度的变化。e)不同色氨酸浓度下c-ZIF-8沉积时间对r值的影响。f)色氨酸浓度为33µm时c-ZIF-8的ηL/D值随沉积时间的变化。
通过调节电沉积时间(记为c-ZIF-8-xh, x为沉积时间)可以控制c-ZIF-8的沉积量,从而可以研究c-ZIF-8的用量对手性识别性能的影响。沉积时间在2 h内的c-ZIF-8膜(如c-ZIF-8- pet -1 h和c-ZIF-8- pet -2 h)对L-Trp具有选择性识别能力。L-Trp浓度分别为13和33µm时,c-ZIF-8-PET-1 h和c-ZIF-8-PET-2 h的r值达到饱和状态 (图3e),这与c-ZIF-8-PET观察到的线性曲线不同。这种偏差可归因于较短电沉积时间获得的c-ZIF-8-PET的手性结合位点数量有限。手性选择性(ηL/D)随沉积时间的增加而增加(图3f)。
为了进一步了解手性识别过程,作者团队通过测量c-ZIF-8的zeta电位,研究了c-ZIF-8的表面电荷状态。
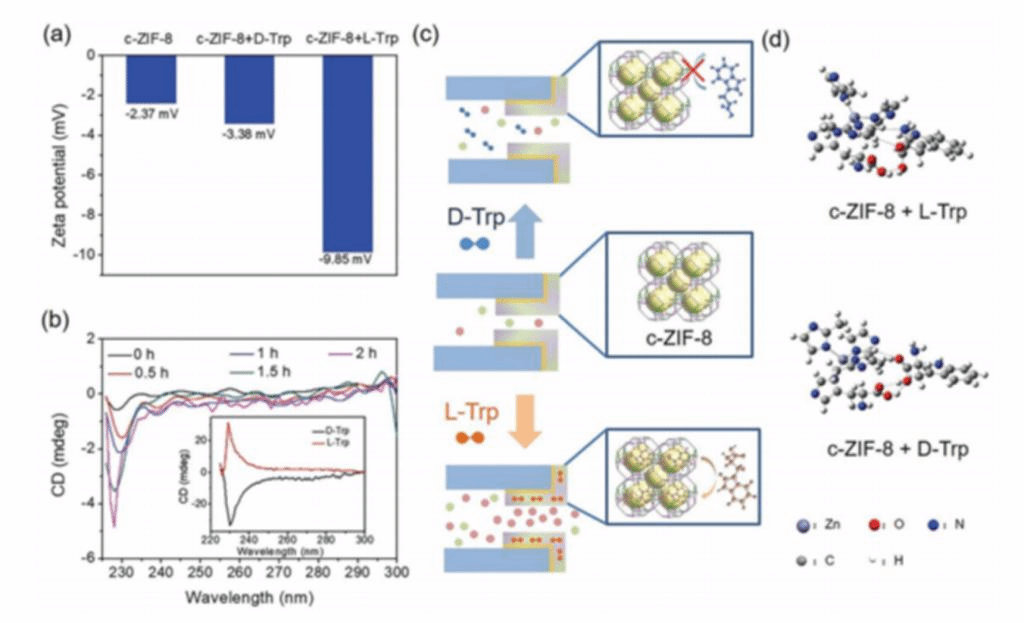
图4、手性识别机制研究。a) D-或L-Trp处理后c-ZIF-8膜的Zeta电位。b) Trp外消旋混合物与c-ZIF-8粒子作用不同时间的CD光谱。如图所示为D-和L-Trp的CD信号。c) c- ZIF -8对D-或L-Trp的识别示意图。d) c-ZIF-8与L-/D - Trp的相互作用模式和吸附能。
D-Trp存在时,c-ZIF-8的zeta电位几乎保持不变(- 3.38 mV),而L-Trp存在时,c-ZIF-8的zeta电位变为-9.85 mV(图4a)。zeta电位的增加表明表面电荷密度的增加,这主要是由于带负电的L-色氨酸分子(等电点,5.89)在c-ZIF-8层上的选择性吸附所致。c-ZIF-8粒子与Trp外消旋混合物相互作用的CD光谱也证实了这种手性选择性吸附。如图4b所示,在234 nm处,D-Trp向下的吸收峰不断增大,说明c-ZIF-8粒子对L-Trp分子的持续吸附。相比之下,非手性ZIF-8粒子存在时,Trp外消旋混合物的CD光谱保持不变。手性选择性吸附导致表面电荷密度增加,有利于反离子涌入膜内,提高离子电流(图4c)。通过密度泛函理论(DFT)计算进一步探讨分子水平上的手性识别机制。L-Trp和D-Trp在c-ZIF-8上的吸附能分别为- 11.85和+1.37 kcal mol- 1(图4d)。L-Trp的吸附能绝对值更大表明L-Trp与c-ZIF-8的结合更有利。
最后为了探究手性分子和手性腔的大小匹配对识别性能的影响,作者测量了c-ZIF-8-PET对三种相似但大小不同的手性氨基酸的电流响应,即Ala (4.1 × 4.5Å ;等电点,6.00),Leu (4.3 × 6.5 Å;等电点,5.98),Trp (6.7 × 7.5 Å;等电点,5.89)(图5a)发现Ala和Leu诱导的电流响应都比Trp小得多,这表明c-ZIF-8对Ala或Leu的亲和力都不佳。由于c-ZIF-8内部的手性腔大小为8.1 Å(图5b),因此尺寸匹配效应可能在手性识别中发挥重要作用。此外,发现c-ZIF-8对Ala和Leu对映体的手性选择性(ηL/D))接近1,表明无手性选择性(图5c)。而除了空腔的大小外,邻近基团的存在也会改变受限的纳米手性环境。因此,研究了Zn2+与2-醛基咪唑(ICA)和L-His配体配位形成的单一手性ZIF-90 (c-ZIF-90)的手性识别性能。c-ZIF-90与c-ZIF-8具有相似的晶体结构和空腔尺寸。然而,ICA配体上醛基的存在使得它可以与手性分子形成额外的氢键,从而改变手性腔环境。
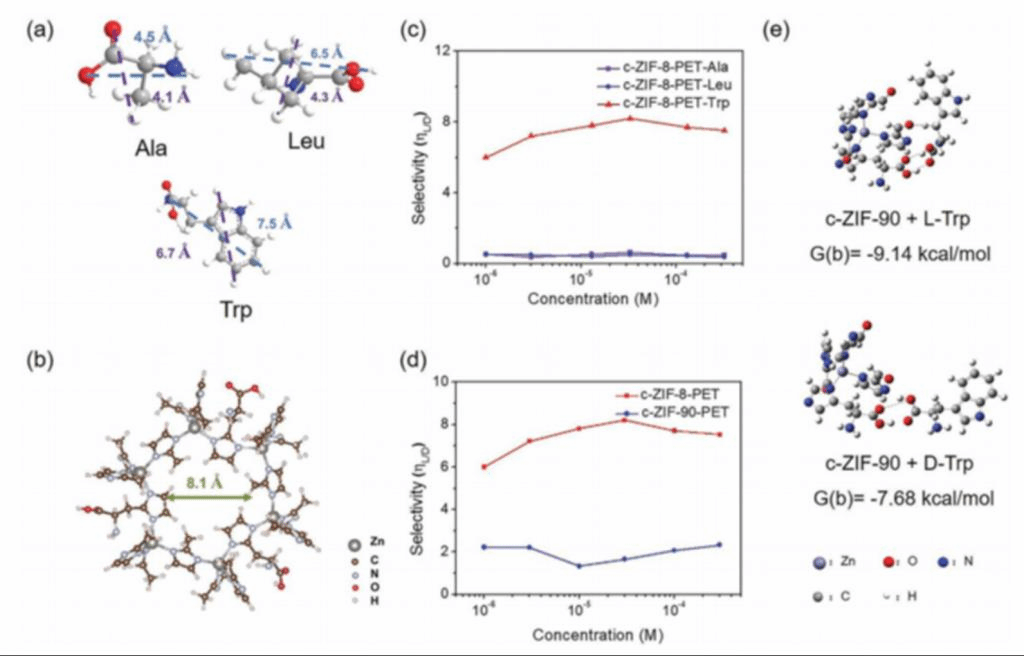
图5、手性环境对手性识别的影响。a) ChemBio3D计算的Ala、Leu和Trp分子的大小。b) c-ZIF-8骨架结构模型。计算得到空腔尺寸为8.1 Å。c) ηL/D值随手性分子的变化(色氨酸,绿色曲线;Ala,粉色曲线;亮氨酸,蓝色曲线)c-ZIF-8-PET浓度。d) c-ZIF-8-PET和c-ZIF-90-PET的ηL/ D值随色氨酸浓度的变化。e) c-ZIF-90与L-/D-Trp的相互作用模式和吸附能。
通过CD谱和XRD图可以证实L-His配体在不破坏ZIF-90晶体结构的情况下成功结合到ZIF-90结构中。目前c-ZIF-90-PET对Trp对映体的响应和手性选择性(图5d)小于c-ZIF-8-PET,表明其手性识别性能较差。DFT计算结果表明,L-Trp在c-ZIF-90上的吸附能(-9.14 kcal mol−1)小于c-ZIF-8 (-11.85 kcal mol−1)。醛基的存在增强了D-Trp与手性位点的相互作用(吸附能为- 7.68 kcal mol -1)。L-Trp和D-Trp在c-ZIF-90上的吸附能差异很小,导致手性选择性不明显(图5e)。这些结果足以证明了邻近基团对受限的纳米空间中的手性识别也会产生影响。
综上所述,作者提出了一种简单的电化学方法,以PET纳米通道阵列为衬底制备单一手性c-ZIF-8层。由于c-ZIF-8具有明确的手性微环境,因此c-ZIF-8对尺寸匹配的Trp对映体具有优异的识别性能。此外探究了手性环境在调节手性识别过程中的作用机理。作者认为,利用这些结论在将来或许可以进一步发展一种手性分离膜。例如,根据尺寸匹配效应,推荐一种通道尺寸与手性分子相当的膜。它不仅可以防止手性分子直接通过通道的中心区域,而且可以增强手性位点与手性分子之间的相互作用。根据邻基对手性识别的影响,可以通过修饰邻基来调节对映体对吸附能的差异。这种吸附能的差异会进一步产生对映体对跨膜扩散速率的差异,从而实现手性分离。本研究为探究手性识别机制提供了一个理想的体系,并为高性能手性传感和分离装置的构建提供启发。
文字 王诺
审核 叶曦翀
参考文献:DOI: 10.1002/smll.202301460
https://doi.org/10.1002/smll.202301460