ACS Appl. Mater. | 构建手性荧光探针用于色氨酸对映体/抗坏血酸的识别
今天与大家分享一篇发表在ACS Applied Materials & Interfaces上的文章,标题是“构建手性荧光探针用于色氨酸对映体/抗坏血酸的鉴定”。本文的通讯作者为济南大学材料学院的赵松方教授。
手性在自然界中无处不在。手性的研究对于食品科学、生物医学、生命科学、加密科学等领域具有重要意义。对映体互为镜像,像我们的“左手”和“右手”一样。生命体中的氨基酸都是左旋的。氨基酸的两种对映体通常具有不同的药理和生物学活性。一种有益于疾病的治疗,而另一种无效甚至有严重的副作用。色氨酸是人体必需的九大氨基酸之一。L-色氨酸在蛋白质、血清素等合成中起重要作用。D-色氨酸是治疗麻风病的重要营养物质。所以,高效识别D/L-色氨酸是非常必要的。传统的对映体识别方法存在繁琐、成本高、稳定性差等缺点。与之相比,荧光法具有检测简单、成本低等优点。目前,结合荧光量子点与金属离子以构建荧光探针受到了广泛的关注,有助于手性催化、手性合成、对映体识别等应用的发展。
在本文中,作者使用柠檬酸、乙二胺、乙二醇合成了荧光碳点(EE),并用L-半胱氨酸进行手性修饰,得到了手性荧光碳点(CCDs)。将Fe3+与CCDs络合,构建了F-CCDs。
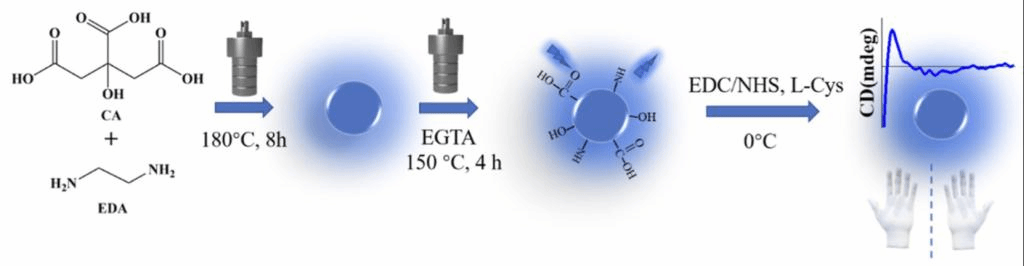
图1、CCDs的合成路线
图2a显示了CCDs的紫外-可见吸收、激发和发射光谱。CCDs的吸收峰在348 nm,归因于C=O和C=N的n-π*跃迁。CCDs的最佳激发波长为345 nm,接近吸收峰,最大发射波长为450 nm。插图显示了CCD水溶液在紫外光下呈现明亮的蓝色荧光。CCDs的绝对荧光量子产率为23.63%。CCDs无法对多种左旋物质产生特定响应(图2b)。CCDs仅对Fe3+有特异性响应(图2c)。Fe3+的吸收峰在298 nm,F-CCDs有 296和548 nm的两个吸收峰(图2e)。与CCDs和Fe3+相比,F-CCDs的两个吸收峰的强度增加。根据时间分辨荧光衰减曲线(图2f)可以看出,CCDs的荧光寿命为5.02 ns,F-CCDs的荧光寿命为4.84 ns,二者之比为1.03。根据上述的光谱分析,作者认为CCDs对Fe3+的特异性荧光猝灭响应可能是表面形成强螯合的不发光基态络合物F-CCDs导致的。随后,作者研究了Fe3+浓度对CCDs荧光的影响,并选择80 μM作为最佳Fe3+浓度用于后续实验。
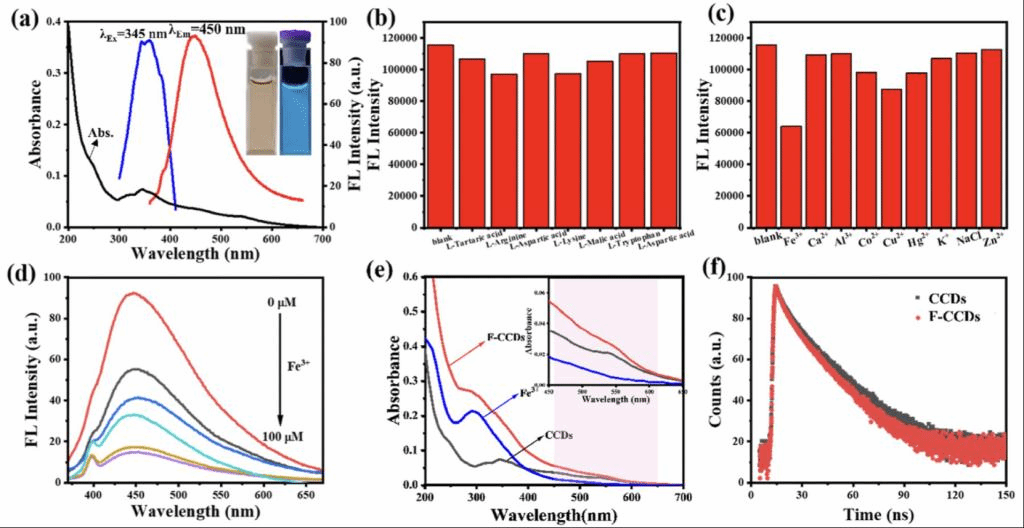
图2、(a) CCDs的紫外-可见吸收(黑色)、激发(蓝色)、发射(红色)光谱。(a)中插图为CCD水溶液在可见光(左)和紫外光(右)下的光学照片。(b-c) 左旋物质(80 μM)和金属离子(80 μM)诱导CCDs的相对荧光强度。(d) CCDs的荧光强度随Fe3+浓度(0~100 μM)的变化。(e) CCDs、Fe3+、F-CCDs的吸收光谱。(f) CCDs(黑色)和F-CCDs(红色)的时间分辨荧光衰减。
F-CCDs对大多数的左旋物质没有明显的响应,而与L-抗坏血酸接触后,有明显的荧光恢复,并保持发射峰位置(图3a)。随着L-色氨酸浓度的增加,F-CCDs的荧光强度逐渐恢复,发射峰发生蓝移(图3c)。而D-色氨酸的加入并不会使F-CCDs的荧光强度发生变化(图3b)。所以,作者认为这是识别L-色氨酸的重要依据。F-CCDs的荧光强度的变化与L-色氨酸浓度呈线性关系,并得到拟合方程(图3d)。
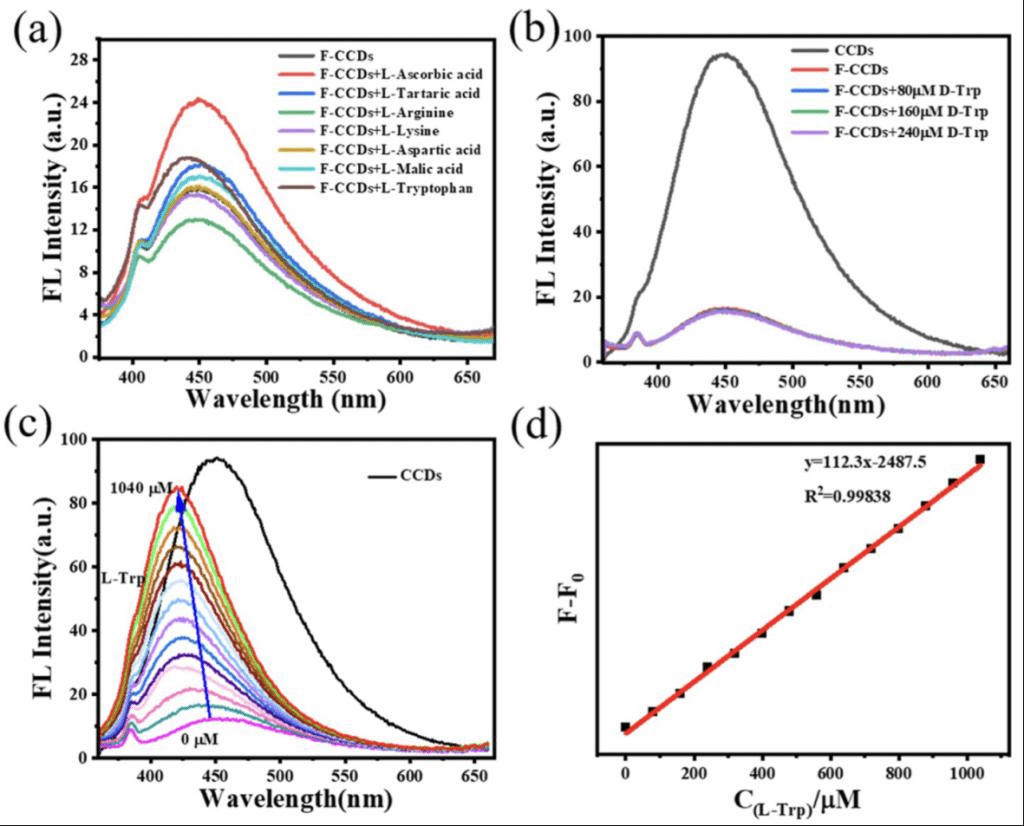
图3、(a) 左旋物质(160 μM)诱导F-CCDs的相对荧光强度。(b) F-CCDs的荧光强度随D-色氨酸浓度(0-240 μM)的变化。(c) F-CCDs的荧光强度随L-色氨酸浓度(0-1040 μM)的变化。(d) F-CCDs的荧光强度变化与L-色氨酸浓度(0-1040 μM)的线性关系。
除了L-色氨酸之外,L-抗坏血酸和D-异抗坏血酸均能改善F-CCDs的荧光,表现出相似的荧光响应趋势(图4a、c)。F-CCDs的荧光强度的变化与L-抗坏血酸和D-异抗坏血酸呈非线性关系,并得到拟合方程(图4b、d)。综上,F-CCDs不能区分抗坏血酸的两种对映体,但对抗坏血酸的高选择性荧光反应依然证实了其鉴定抗坏血酸的潜力。
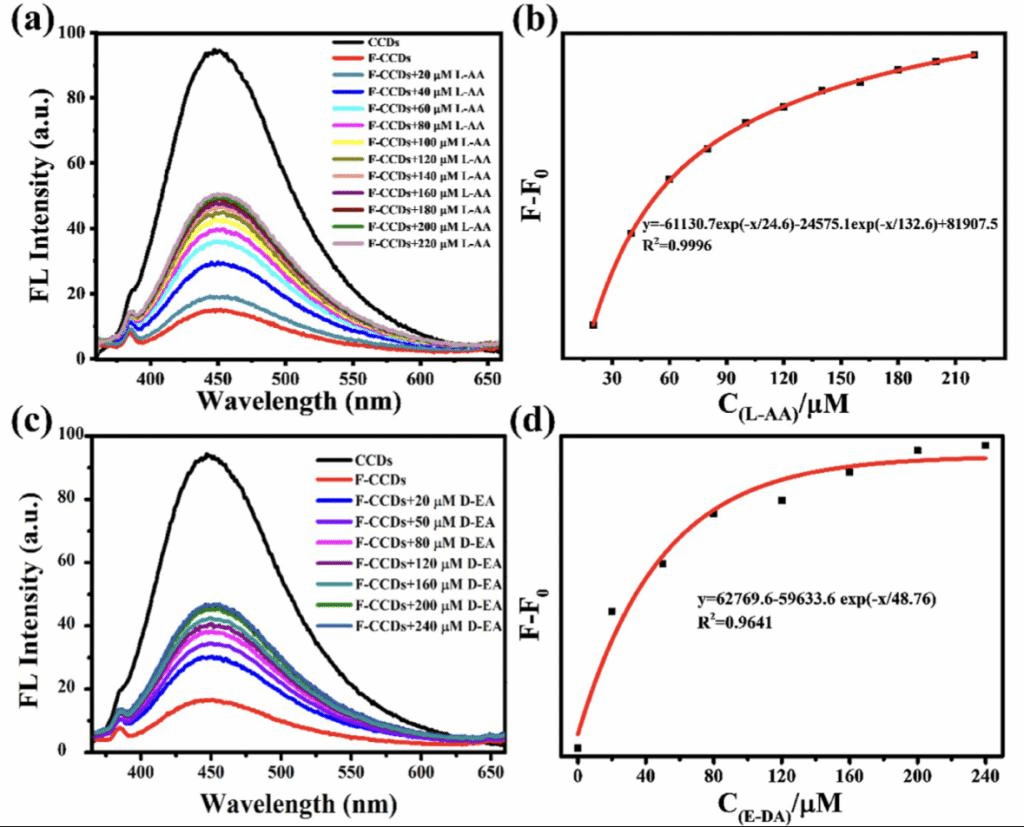
图4、(a) F-CCDs的荧光强度随L-抗坏血酸浓度(0-220 μM)的变化。(b) F-CCDs的荧光强度变化与L-抗坏血酸浓度(0-220 μM)的指数关系。(c) F-CCDs的荧光强度随D-异抗坏血酸浓度(0-240 μM)的变化。(d) F-CCDs的荧光强度变化与D-异抗坏血酸浓度(0-240 μM)的指数关系。
紫外-可见吸收光谱和时间分辨荧光衰减用于进一步研究F-CCDs对 L-抗坏血酸荧光响应的潜在机制。首先,即使没有Fe3+,L-抗坏血酸也会导致CCDs荧光猝灭。CCDs和CCDs-L-抗坏血酸的荧光寿命比率接近于1(图5a)。这表明CCDs和L-抗坏血酸之间的相互作用导致CCDs荧光的静态猝灭。另一方面,根据F-CCDs和F-CCDs-L-抗坏血酸的紫外-可见吸收光谱,发现L-抗坏血酸与Fe3+形成铁-抗坏血酸络合物(图5b)。抗坏血酸与Fe3+在水溶液中存在强络合作用。因此,Fe3+从CCDs表面脱离,CCDs发出荧光,导致荧光恢复。然而,发射峰的位置保持不变。CCDs、Fe3+和L-抗坏血酸之间的竞争关系意味着一些释放的 CCD会再次与L-抗坏血酸结合,导致荧光无法完全恢复(图5c)。
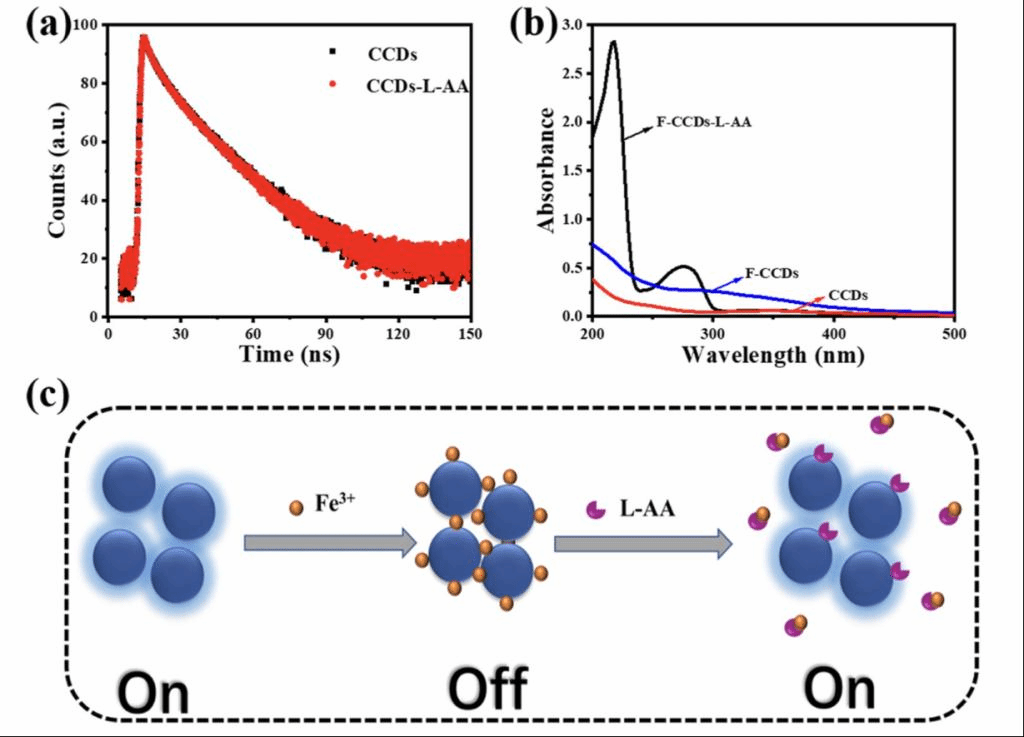
图5、(a) CCDs和CCDs-L-抗坏血酸的时间分辨荧光衰减。(b) CCDs、Fe3+、F-CCDs-L-抗坏血酸的吸收光谱。 (c) F-CCDs对L-抗坏血酸的识别机制。
为了阐明F-CCDs识别L-色氨酸时蓝移的原因,作者比较了Fe3+是否存在对CCDs荧光响应的影响,发现蓝移现象的发生是由于CCDs与L-色氨酸之间的相互作用。F-CCDs与L-色氨酸之间不存在成键相互作用。这是因为L-色氨酸/D-色氨酸、CCDs-L-色氨酸/CCDs-D-色氨酸和F-CCDs-L-色氨酸的紫外-可见吸收光谱的峰位没有显著差异。为了更深入地了解手性识别机制,作者进行了DFT模拟。图6显示了手性前体L-半胱氨酸与L-色氨酸或D-色氨酸之间可能的结合模式和氢键位置。DFT模拟结果表明立体化学选择性和氢键在F-CCDs对L-色氨酸的手性识别机制中起重要作用。
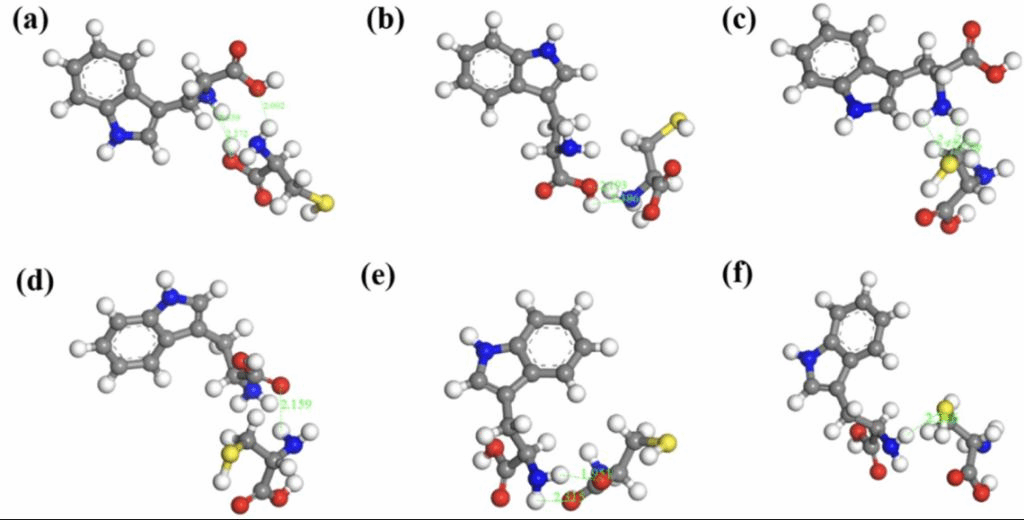
图6、(a-c) L-半胱氨酸与L-色氨酸之间可能的相互作用。(d-f) L-半胱氨酸与D-色氨酸之间可能的相互作用。
综上,作者通过水热法和手性修饰合成了具有优异发光性能的CCDs。F-CCDs荧光探针成功识别色氨酸对映体,可鉴定抗坏血酸。L-色氨酸可以显著增强F-CCDs的荧光强度,并使其发射峰发生蓝移。而D-色氨酸对F-CCDs无影响。作者通过紫外-可见吸收光谱、时间分辨荧光衰减和DFT模拟进一步分析了荧光响应机理和手性识别机理。这种绿色环保的荧光响应方法有望促进手性分子特异性识别技术在智能传感领域中的应用。
文字 孟馨玥
审核 叶曦翀
参考文献:DOI: 10.1021/acsami.3c02423
https://doi.org/10.1021/acsami.3c02423